NEOPLASIAS DA VULVA E DA VAGINA
Rodrigo Fonseca Abreu, Louise De Brot
Introdução
Este capítulo tem como objetivo ser um guia de consulta para a elaboração de laudos anatomopatológicos das neoplasias de vulva e vagina. Ele foi elaborado com base em protocolos validados e amplamente utilizados internacionalmente. É uma forma de lembrar dos principais pontos a serem reportados e de padronizar os laudos. No entanto, entende-se que cada espécime deve ser examinado de forma individualizada.
Códigos de topografia
C51.0 Grande lábio
C51.1 Pequeno lábio
C51.2 Clitóris
C51.8 Lesão com envolvimento de mais de uma região anatômica vulvar
C51.9 Vulva, SOE
C52.9 Vagina, SOE
- Identificação
- Nome completo
- Data de nascimento
- Número do prontuário
- Número de registro no laboratório
- Data e horário do procedimento
- Data da requisição do exame
- Dados clínicos
- Antecedente pessoal de câncer (especificar)
- Tratamento neoadjuvante prévio (especificar)
- Outros (especificar)
- Informações não fornecidas
III. Exame macroscópico
III.1 Vulva
Espécime/procedimento realizado
- Biópsia incisional
- Excisão
- Local
- Ampla
- Vulvectomia
- Parcial
- Total
- Radical
- Não especificado
- Outro (especificar) _____________
Medidas do espécime
- Especificar em milímetros ___ x ___ x ___ mm
Focalidade da(s) lesão(ões)
- Unifocal
- Multifocal
- Não pode ser determinada (explicar)
- Não especificada
Localização da lesão
- Hemivulva direita
- Grande lábio
- Pequeno lábio
- Glândula de Bartholin
- Hemivulva esquerda
- Grande lábio
- Pequeno lábio
- Glândula de Bartholin
- Linha média/ central/ clitóris/ períneo
- Outra (especificar)
Padrão de crescimento
- Exofítico
- Ulcerado
- Plano
- Outro (especificar) _____________
Dimensões da lesão
Maior dimensão horizontal da lesão: ____ mm
Profundidade de infiltração: ____ mm
– Correlacionar com o exame microscópico para uma única medida –
- Não pode ser mensurado (especificar)
Linfonodos
Localização e número de estruturas identificadas ao exame macroscópico
III.2 Vagina
Espécime/procedimento realizado
- Biópsia
- Incisional
- Excisional
- Ressecção local
- Vaginectomia
- Parcial
- Radical
- Não especificado
- Outro (especificar) _____________
Medidas do espécime
- Especificar em milímetros ___ x ___ x ___ mm
Localização da lesão
- Vagina
- Terço superior
- Terço médio
- Terço inferior
- Não especificado
Dimensões da lesão
Maior dimensão em centímetros: ____ cm
Dimensões adicionais em centímetros: ____ x ____ cm
– Correlacionar com o exame microscópico para uma única medida –
- Não pode ser mensurado (especificar)
Linfonodos
Localização e número de estruturas identificadas ao exame macroscópico
- Exame microscópico
Deve informar: diagnóstico microscópico, extensão, tipo e grau histológico da neoplasia, dimensões, localização, profundidade máxima de invasão, presença ou ausência de invasão angiolinfática, relação com estruturas adjacentes, número, localização e estado dos linfonodos, estado das margens de ressecção cirúrgica e eventuais lesões associadas.
O carcinoma de células escamosas é o tipo histológico mais frequente em vulva e vagina. Aproximadamente 10% dos carcinomas da vagina são adenocarcinomas.
IV.1 Vulva
IV.1.1 Tipo histológico
Carcinoma de células escamosas
- Carcinoma de células escamosas relacionado ao HPV
- Carcinoma de células escamosas não relacionado ao HPV
- Carcinoma de células escamosas, sem outra especificação (SOE)
- Carcinoma de células basais/basocelular
Tumores glandulares
Lesões tipo glândula mamária
- Tumor Phyllodes (borderline, maligno – especificar)
- Adenocarcinoma tipo glândula mamária
Lesões da glândula de Bartholin
- Carcinoma da glândula de Bartholin (especificar o tipo)
Adenocarcinoma de outros tipos
- Adenocarcinoma, SOE
- Doença de Paget, extramamária
- Adenocarcinoma tipo intestinal
- Adenocarcinoma de origem em glândulas sudoríparas
- Adenocarcinoma apócrino
- Adenocarcinoma écrino
Neoplasias neuroendócrinas
Tumor neuroendócrino
- Tumor neuroendócrino (SOE)
- Tumor neuroendócrino (grau 1)
- Tumor neuroendócrino (grau 2)
Carcinoma neuroendócrino
- Carcinoma neuroendócrino de pequenas células
- Carcinoma neuroendócrino de grandes células
- Carcinoma tipo não-neuroendócrino com componente neuroendócrino
Tumores de células germinativas
- Tumor do seio endodérmico (Yolk sac)
- Outro (especificar)
Outros tipos de carcinoma
- Porocarcinoma, SOE
- Carcinoma adenoide-cístico
- Carcinoma adenoescamoso
- Carcinoma pouco diferenciado, SOE
Outros tipos histológicos não listados
- Especificar_______________
* Nota: A patogênese do carcinoma de células escamosas vulvar pode ocorrer por duas diferentes vias. A primeira via (relacionada ao HPV) envolve a neoplasia intraepitelial vulvar clássica (NIV)/ lesão escamosa intraepitelial de alto grau (HSIL), e está associada aos subtipos de alto risco do papilomavirus humano (HPV), sendo similar histologicamente às lesões escamosas vistas no colo uterino. Tende a ser multifocal, com predominância em mulheres jovens e, relativamente, menor risco de progressão para CEC invasivo. No geral, a marcação imuno-histoquímica para p16 é difusa (em bloco), refletindo associação com o HPV. O componente invasivo associado geralmente é basaloide ou verrucoso. A segunda via se manifesta como NIV diferenciado (dNIV) e não é relacionada ao HPV, mas sim com a distrofia vulvar, como o líquen escleroso, acantose vulvar com diferenciação anômala (VAAM), lesão intraepitelial vulvar exofítica diferenciada (DEVIL), líquen simples crônico e hiperplasia de células escamosas. Apresentam expressão aberrante de p53 (null, expressão forte e contigua ou superexpressão citoplasmática) e p16 negativo ou padrão mosaico). O componente invasivo associado é ceratinizante e geralmente associado a mutação no p53. Ocorrem, com maior frequência em mulheres mais velhas. Lesões com sobreposição de características histológicas e/ou clínicas dessas duas vias podem ocorrer.
IV.1.2 Grau histológico
- Grau 1 – Bem diferenciado
- Grau 2 – Moderadamente diferenciado
- Grau 3 – Pouco diferenciado
- Outro (especificar)
- GX, não pode ser avaliado
- Não se aplica
* Nota: Células indiferenciadas: pequenas, com citoplasma escasso mostrando pouca ou nenhuma diferenciação e infiltrando o estroma em cordões alongados ou em pequenos agrupamentos.
Tamanho da lesão ___ x ___ x ___ cm. Maior dimensão ___ cm
Profundidade de invasão
- Especificar em milímetros (mm)
- Não pode ser determinada (explicar)
Borda tumoral (padrão de invasão)
- Expansiva
- Infiltrativa
- Outra (especificar)
Extensão para outros tecidos/órgãos
- Não aplicável
- Não avaliável
- Vagina
- Terço inferior
- Dois terços superiores
- Uretra
- Terço inferior
- Dois terços superiores
- Mucosa vesical
- Mucosa retal
- Osso pélvico
- Ânus
- Outros órgãos/tecidos (especificar)
Invasão angiolinfática
- Não detectada
- Presente
- Equívoca (explicar)
- Não pode ser determinada (explicar)
Margens cirúrgicas
Avaliação para o tumor invasivo
- Não aplicável
- Não avaliável
- Livres
- Distância entre o tumor e a margem de pele ou mucosa mais próxima (mm)
- Especificar a margem mais próxima
- Comprometidas (especificar as margens comprometidas)
Avaliação para as lesões precursoras
- Não aplicável
- Não avaliável
- Livres
- Distância entre a lesão precursora de alto grau e a margem mais próxima (mm)
- Especificar a margem mais próxima
- Distância entre o tumor e a margem profunda (mm)
- Comprometidas (especificar as margens comprometidas)
Linfonodos
Linfonodos regionais (inguinofemorais)
- Não aplicável
- Linfonodos não submetidos ou não encontrados
Sítio (especificar): ___________
Número de linfonodos examinados: ___________
Número de linfonodos comprometidos por neoplasia: ___________
Tamanho do maior depósito tumoral em milímetros: ___________
Extensão extranodal:
- Presente
- Ausente
Classificação das metástases linfonodais
- Número de linfonodos com metástases ≥ 5,0 mm
- Número de linfonodos com metástases < 5.0 mm (excluindo células tumorais isoladas)
- Número de linfonodos com células tumorais isoladas ≤ 0.2mm
Número de linfonodos sentinelas examinados: _____________
Lesões precursoras associadas
- Não identificadas
- Lesão escamosa intraepitelial de baixo grau (LSIL), relacionado ao HPV
- Lesão escamosa intraepetilial de alto grau (HSIL), relacionado ao HPV
- Líquen escleroso
- Outra (especificar)
IV.2 Vagina
IV.2.1 Tipo histológico
Tumores epiteliais
Carcinoma de células escamosas
- Carcinoma de células escamosas relacionado ao HPV
- Carcinoma de células escamosas não relacionado ao HPV
- Carcinoma de células escamosas, sem outra especificação (SOE)
Tumores glandulares
- Adenocarcinoma relacionado ao HPV
- Carcinoma endometrioide da vagina
- Carcinoma de células claras da vagina
- Carcinoma mucinoso, tipo gástrico
- Carcinoma mucinoso, tipo intestinal
- Adenocarcinoma mesonéfrico da vagina
- Carcinossarcoma da vagina
Outros tumores epiteliais
- Tumor misto da vagina
- Adenocarcinoma com origem na glândula de Skene
- Carcinoma adenoescamoso da vagina
- Carcinoma basal adenoide da vagina
Tumores mistos epitelial e mesenquimal
- Adenossarcoma da vagina
Miscelânea
- Tumor de células germinativas da vagina (especificar)
Neoplasias neuroendócrinas
Tumor neuroendócrino
- Tumor neuroendócrino (SOE)
- Tumor neuroendócrino (grau 1)
- Tumor neuroendócrino (grau 2)
Carcinoma neuroendócrino
- Carcinoma neuroendócrino de pequenas células
- Carcinoma neuroendócrino de grandes células
- Carcinoma tipo não-neuroendócrino com componente neuroendócrino
Outros tipos de carcinoma
- Carcinoma indiferenciado
- Tumores mistos, SOE
Outros tipos histológicos não listados
- Especificar_______________
IV.2.2 Grau histológico
- Grau 1 – Bem diferenciado
- Grau 2 – Moderadamente diferenciado
- Grau 3 – Pouco diferenciado
- Outro (especificar)
- GX, não pode ser avaliado
- Não se aplica
Extensão para outros tecidos/órgãos
- Não aplicável
- Não avaliável
- Contido pela parede vaginal
- Envolve partes moles da região subepitelial
- Envolve a parede muscular
- Tecidos paravaginais
- Parede pélvica lateral
- Vagina, terço inferior
- Mucosa vesical
- Mucosa retal
- Regiões além da pelve verdadeira (especificar)
- Outros órgãos/tecidos (especificar)
Invasão angiolinfática
- Não detectada
- Presente
- Equívoca (explicar)
- Não pode ser determinada (explicar)
Margens cirúrgicas
Avaliação para o tumor invasivo
- Não aplicável
- Não avaliável
- Livres
- Distância entre o tumor e a margem mais próxima (mm)
- Especificar a margem mais próxima
- Distância entre o tumor e a margem profunda (mm)
- Comprometidas (especificar as margens comprometidas)
Avaliação para as lesões precursoras
- Não aplicável
- Não avaliável
- Livres
- Distância entre a lesão precursora de alto grau e a margem mais próxima (mm)
- Especificar a margem mais próxima
- Comprometidas (especificar as margens comprometidas)
Linfonodos
Linfonodos regionais
Para os dois terços superiores da vagina: pélvico SOE, parametrial, obturador, ilíaca interna (hipogástrio), ilíaca externa, sacral, pré-sacral e para-aórtico. Para o terço inferior da vagina: inguinal e femoral.
- Não aplicável
- Linfonodos não submetidos ou não encontrados
Sítio (especificar): ___________
Número de linfonodos examinados: ___________
Número de linfonodos comprometidos por neoplasia: ___________
Tamanho do maior depósito tumoral em milímetros: ___________
Extensão extranodal:
- Presente
- Ausente
Classificação das metástases linfonodais
- Número de linfonodos com células tumorais isoladas ≤ 0.2 mm
Número de linfonodos sentinelas examinados: _____________
Lesões precursoras associadas
- Não identificadas
- Lesão escamosa intraepitelial de baixo grau
- Lesão escamosa intraepitelial de alto grau
- Adenocarcinoma in situ
- Adenose
- Outras (especificar)
- Diagnóstico final (exemplo)
- Produto de vulvectomia radical com linfadenectomia inguinofemoral bilateral.
• Carcinoma de células escamosas bem diferenciado, queratinizante, medindo 2,6 x 1,4 x 1,3 cm, localizado em grande lábio esquerdo, com profundidade máxima de invasão de 3 mm.
• Invasão linfovascular não detectada.
• Margens de ressecção cirúrgica cutânea, vaginal e profunda livres de acometimento neoplásico.
• Ausência de metástase nos 8 linfonodos inguinofemorais dissecados (4 à direita e 4 à esquerda).
• Presença de neoplasia intraepitelial vulvar do tipo diferenciado (NIV-d), adjacente à lesão.
• Presença de líquen escleroso, distante da lesão. Estadiamento patológico: pT1b pN0; Figo IB.
Comentários
Classificação FIGO e TNM
1 Classificação FIGO e TNM dos carcinomas de vulva
FIGO (Edição de 2018)
- I – Tumor confinado à vulva
- IA – Lesões ≤2,0 cm, confinadas à vulva ou ao períneo e com invasão estromal ≤1,0 mm, sem metástase linfonodal
- IB – Lesões >2,0 cm ou com invasão estromal >1,0 mm, confinadas à vulva ou ao períneo, sem metástase linfonodal
- II – Tumor de qualquer tamanho com extensão para estruturas perineais adjacentes (terço inferior da uretra; terço inferior da vagina; ânus), sem metástase linfonal
- III – Tumor de qualquer tamanho com ou sem extensão a estruturas perineais adjacentes (terço inferior da uretra; terço inferior da vagina; ânus), com metástase em linfonodos inguinofemorais
- IIIA(i) – Uma metástase linfonodal (≥5,0 mm)
- IIIA(ii) – Uma a duas metástases linfonodais (<5,0 mm)
- IIIB(i) – Duas ou mais metástases linfonodais (≥5,0 mm)
- IIIB(ii) – Três ou mais metástases linfonodais (<5,0 mm)
- IIIC – Metástase linfonodal com extensão extranodal
- IV – O tumor invade outras estruturas locorregionais (dois-terços superiores da uretra; dois-terços superiores da vagina) ou estruturas distantes
- IVA – O tumor invade qualquer uma das estruturas a seguir:
- IVA(i) – Uretra superior e/ou mucosa vaginal, mucosa vesical, mucosa retal ou fixo a osso pélvico
- IVA(ii) – Linfonodos inguinofemorais fixos ou ulcerados
- IVB – Qualquer metástase à distância, incluindo linfonodos pélvicos
TNM (8ª edição, 2016)
Descritores (se aplicável)
- m – tumores primários múltiplos
- r – recorrência
- y – pós-terapia
pT – Tumor primário
- TX – O tumor primário não pode ser avaliado
- T0 – Não há evidência de tumor primário
- Tis – Carcinoma in situ (carcinoma pré-invasivo), neoplasia intraepitelial grau III (NIV III)
- T1 – Tumor confinado à vulva ou à vulva e ao períneo
- T1a – Tumor ≤2,0 cm na maior dimensão e com invasão estromal ≤1,0 mm
- T1b – Tumor >2 cm na maior dimensão e/ou com invasão estromal >1,0 mm
- T2 – Tumor invade qualquer uma das seguintes estruturas: terço inferior da uretra, terço inferior da vagina e ânus
- T3 – Tumor invade qualquer uma das seguintes estruturas perineais: dois-terços superiores da uretra, dois-terços superiores da vagina, mucosa vesical, mucosa retal ou fixo a osso pélvico
pN – Linfonodos regionais*
- NX – Os linfonodos regionais não podem ser avaliados
- N0 – Ausência de metástases em linfonodos regionais
- N1 – Linfonodos regionais metastáticos com as seguintes características
- N1a – Metástase para um ou dois linfonodos, sendo cada uma <5,0 mm
- N1b – Uma metástase linfonodal ≥5,0 mm
- N2 – Metástase linfonodal regional com as seguintes características
- N2a – Metástase para três ou mais linfonodos, sendo cada uma <5,0 mm
- N2b – Metástase para dois ou mais linfonodos, sendo cada uma ≥5,0 mm
- N2c – Metástase linfonodal com extensão extranodal
- N3 – Metástase linfonodal regional fixa ou ulcerada
* Nota: A drenagem linfática das neoplasias vulvares é para os linfonodos femorais e inguinais. Descrever tamanho e lateralidade das metástases.
M – Metástases a distância
- M0 – Ausência de metástases a distância
- M1 (Figo IVB) – Metástase a distância (incluindo metástases para linfonodos pélvicos) (especificar sítio, se conhecido) _____________
Tabela 1 Estadiamento clínico/grupos prognósticos (Figo e categorias TNM) dos carcinomas de vulva
| Estádio | Tis | N0 | M0 |
| I | T1 | N0 | M0 |
| IA | T1a | N0 | M0 |
| IB | T1b | N0 | M0 |
| II | T2 | N0 | M0 |
| IIIA | T1, T2 | N1a, N1b | M0 |
| IIIB | T1, T2 | N2a, N2b | M0 |
| IIIC | T1, T2 | N2c | M0 |
| IVA | T1, T2 | N3 | M0 |
| T3 | Qualquer N | M0 | |
| IVB | Qualquer T | Qualquer N | M1 |
2 Classificação FIGO e TNM dos carcinomas da vagina
FIGO (Edição de 2018)
- I – Carcinoma confinado à parede vaginal. Não há metástase para linfonodos regionais (N0), nem para sítios distantes (M0)
- II – Carcinoma envolve o tecido para-vaginal, mas não se estende para a parede pélvica. Não há metástases para linfonodos regionais (N0), nem para sítios distantes (M0)
- III – Carcinoma se estende para a parede pélvica e/ou terço-inferior da vagina e/ou causa hidronefrose ou insuficiência renal ou tumores T1-T3 com metástase para linfonodos regionais da pelve ou região inguinal (N1), mas não para sítios distantes
- IV – Carcinoma se estende para além da pelve verdadeira ou envolve as mucosas vesical ou retal (edema bolhoso não permite classificar a lesão como estágio IV)
- IVA – Tumor invade as mucosas vesical e/ou retal e/ou se estende diretamente para além da pelve verdadeira. Pode ou não haver metástase para linfonodos pélvicos ou inguinais (qualquer N). Não há metástases à distância (M0)
- IVB – Metástase para órgãos à distância (M1). Pode ser de qualquer tamanho e ter ou não crescimento para órgãos e estruturas locorregionais (qualquer T). Pode ou não ter metástase para linfonodos regionais (qualquer N)
TNM (8ª edição, 2016)
Descritores (se aplicável)
- m – tumores primários múltiplos
- r – recorrência
- y – pós-terapia
pT – Tumor primário
- TX – O tumor primário não pode ser avaliado
- T0 – Não há evidência de tumor primário
- Tis – Carcinoma in situ (carcinoma pré-invasivo)
- T1 – Tumor confinado à vagina
- T2 – Tumor invade os tecidos para-vaginais
- T3 – Tumor se estende para a parede pélvica
- T4 – Tumor invade mucosas vesical ou retal ou se estende para além da pelve verdadeira
pN – Linfonodos regionais*
- NX – Os linfonodos regionais não podem ser avaliados
- N0 – Ausência de metástases em linfonodos regionais
- N1 – Presença de metástases em linfonodos regionais
Tabela 2 Classificação do tumor primário de vagina.
| TNM | Categorias/estádios | Figo |
| TX | O tumor primário não pode ser avaliado | – |
| T0 | Sem evidência de tumor primário | – |
| Tis | Carcinoma in situ (carcinoma pré-invasivo) | – |
| T1 | Tumor confinado à vagina | I |
| T2 | O tumor invade tecidos paravaginais, mas não se estende à parede pélvica | II |
| T3 | O tumor se estende à parede pélvica | III |
| T4 | O tumor invade a mucosa vesical ou retal e/ou se estende além da pelve verdadeira | IVA |
Nota 1: Parede pélvica definida como músculo, fáscia, estruturas neurovasculares ou porções do esqueleto da pelve óssea. Ao exame retal, não há espaço livre de câncer entre o tumor e a parede pélvica.
Nota 2: A presença de edema bolhoso não é evidência suficiente para classificar um tumor como T4.
N – Linfonodos regionais*
* Nota: Linfonodos regionais da vagina: Para os dois terços superiores da vagina: pélvico SOE, parametrial, obturador, ilíaca interna (hipogástrio), ilíaca externa, sacral, pré-sacral e para-aórtico. Para o terço inferior da vagina: inguinal e femoral. Células tumorais isoladas = N1.
M – Metástases a distância
- MX – Metástase a distância não pode ser avaliada
- M0 – Ausência de metástases a distância
- M1 – Metástase a distância (Figo IVB)
Tabela 3 Estadiamento clínico/grupos prognósticos (Figo e categorias TNM) dos carcinomas da vagina.
| Estádio | Tis | N0 | M0 |
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| III | T3 | N0 | M0 |
| T1, T2, T3 | N1 | M0 | |
| IVA | T4 | Qualquer N | M0 |
| IVB | Qualquer T | Qualquer N | M1 |
Nota: O estadiamento patológico pode não representar o estadiamento final da lesão. Este deve ser determinado de forma multidisciplinar, sendo avaliado o conjunto dos dados patológicos, clínicos e radiológicos.
2 Informes clínicos
Para a elaboração de um laudo anatomopatológico acurado e que atenda às necessidades da equipe clínica assistencial e do paciente, é necessário, dentre outros fatores, entender o contexto em que a lesão a ser examinada está inserida. Para isso, ter conhecimento dos antecedentes pessoais do paciente é fundamental. Nesse sentido, a habilidade de comunicação com os demais membros da equipe assistencial é fundamental para o trabalho do patologista, especialmente nos casos em que os dados clínicos não são devidamente informados na requisição do exame anatomopatológico.
Conhecer o histórico prévio de neoplasias (incluindo o sítio), de lesões precursoras ou tratamentos realizados é fundamental para a elaboração do laudo anatomopatológico dos tumores de vulva e vagina. Esse fato é especialmente importante nos casos de carcinoma de células escamosas (CEC), uma vez que é comum a recorrência desse tipo de tumor. Em alguns casos em que a paciente tem histórico prévio de CEC não é possível definir de forma clara através do exame patológico se uma “nova” lesão é uma recorrência ou uma neoplasia independente.
Também é necessário conhecer o histórico de lesões precursoras malignas e, especialmente na topografia de vulva, antecedentes de dermatoses inflamatórias. Nos casos de adenocarcinomas, é importante conhecer o antecedente pessoal de neoplasias malignas para afastar a possibilidade de metástases. Outro exemplo de antecedente relevante a se conhecer, no caso das lesões vaginais, é o diagnóstico prévio de adenose vaginal. Pelo fato de que alguns adenocarcinomas de células claras, do tipo gástrico ou do tipo HPV-relacionado primários da vagina se desenvolvem a partir da adenose, que pode ser esporádica ou secundária à exposição intra-uterina ao dietilstilbestrol.
Já alguns adenocarcinomas endometrioides primários da vagina surgem a partir de lesões de endometriose, podendo ter como fator de risco a exposição estrogênica prolongada sem a contraposição de progestágenos. Tratamentos neoadjuvantes prévios, como quimioterapia e radioterapia, podem provocar alterações macro e microscópicas no espécime, sendo também de suma importância saber se foram realizados. Assim, nota-se a importância da correlação anátomo-clínica.
3 Procedimento cirúrgico
Vulva
A ressecção local ampla se refere à excisão de toda espessura da pele da vulva ou mucosa com preservação do tecido subcutâneo e outros tecidos profundos (terminologias antigas incluem vulvectomia parcial e vulvectomia superficial). Geralmente, esse tipo de ressecção é realizado nos casos de lesões pré-invasivas, lesões não malignas ou para fins diagnósticos.
Vulvectomia radical (parcial ou total) geralmente é realizada nos casos de lesões malignas invasivas confirmadas por biópsia e envolve a excisão do tecido vulvar até a fáscia profunda. Vulvectomia radical pode incluir excisão do clitóris com prepúcio, o lábio maior, o lábio menor, uma porção da vagina, uretra e/ou ânus. A orientação do espécime deve ser realizada pelo cirurgião para que as margens sejam adequadamente avaliadas.
O tipo de procedimento realizado vai depender do tamanho do tumor, do diagnóstico patológico, das expectativas e desejos da paciente.
Vagina
A vaginectomia consiste na excisão da mucosa vaginal por via vaginal ou abdominal e pode ser total ou parcial. A extensão do procedimento depende do tamanho da lesão, sua localização, antecedentes pessoais de tratamentos cirúrgicos ou radioterápicos da região, expectativas da paciente entre outros.
4 Exame macroscópico
4.1 Biópsias incisionais
Sempre que possível, realizar cortes perpendiculares à superfície epitelial. Encaminhar todo o material para estudo histológico.
4.2 Biópsias excisionais
Devem ser processadas de maneira similar às de pele. Utilizar tinta-da-china de diferentes cores para reconhecer e avaliar microscopicamente as margens de ressecção cirúrgica. A orientação de espécimes sem referenciais anatômicos específicos depende da colocação de fios cirúrgicos e/ou da confecção de esquemas ou desenhos pelo cirurgião, o qual deve sempre ser contatado na ausência dessas informações. Caso essa orientação não seja possível, podem ser utilizadas designações com diferentes letras no seguimento do material.
4.3 Excisões vulvares locais amplas
O laser e/ou outras medicações tópicas vêm sendo cada vez mais utilizados no tratamento de lesões do tipo NIV3 ou doença de Paget residual (quando estiver excluída a invasão estromal). Excisões locais amplas são espécimes macroscopicamente muito variáveis na composição. Os espécimes com frequência contêm parte ou totalidade dos pequenos e grandes lábios (estes são o principal sítio primário de carcinomas de células escamosas), clitóris, corpo perineal e tecido perianal, sem gordura subcutânea.
O exame macroscópico deve relatar aspectos, extensão da lesão (ou lesões), estruturas anatômicas envolvidas e distância em relação às margens. Em espécimes não fixados, as lesões intraepiteliais podem exibir coloração variável, branco-acinzentada, avermelhada ou amarronzada e superfície áspera. Deve-se, portanto, examinar cuidadosamente as alterações de coloração (mais difíceis nos espécimes fixados) e textura para poder identificar essas lesões, geralmente discretas e por vezes multifocais.
Assim como em qualquer outro espécime excisional, devem-se incluir cortes devidamente identificados de todas as lesões evidentes, para excluir invasão, e anotar as distâncias destas em relação às margens mais próximas.
Em razão da não infrequente multifocalidade e dificuldade de delimitação macroscópica das lesões, toda a extensão das margens deve ser microscopicamente avaliada por cortes múltiplos perpendiculares às linhas de ressecção, que possuem a vantagem de, em uma mesma lâmina, permitir a observação da lesão central, da área de transição e da margem.
Fotomacrografias ou esquemas desenhados podem ser úteis em espécimes complexos (limites anatômicos mal definidos, lesões múltiplas ou ambos).
4.4 Vulvectomias totais: superficial e profunda
Vulvectomias totais são espécimes cirúrgicos que contêm toda a vulva. As superficiais contêm pele e o mínimo de tecido subcutâneo e podem ser realizadas como tratamento para NIV extensa. As profundas geralmente são realizadas para o tratamento cirúrgico de tumores invasivos maiores (quando a vulvectomia parcial profunda não é considerada adequada) ou doença de Paget extensa. Assemelham-se a vulvectomias superficiais, contendo ainda a gordura subcutânea.
Após a identificação das margens com tinta-da-china, o espécime deve ser cortado em fatias de 0,5 cm para avaliar eventual presença de invasão ou outra neoplasia associada.
Caracteristicamente, a extensão microscópica da doença de Paget excede a macroscopicamente visível, observando-se focos ocultos em epitélio aparentemente normal, devendo, portanto, ser toda a extensão das margens submetida a exame microscópico, como anteriormente descrito.
4.5 Vulvectomias radicais com linfadenectomia
Geralmente produto do tratamento cirúrgico de carcinomas de células escamosas francamente invasivos, o espécime consiste em vulva, pele inguinal, tecido subcutâneo, linfonodos inguinofemorais (que drenam clitóris, vestíbulo e grandes lábios, presentes em “asas” superolaterais de partes moles ou enviados separadamente) e porções das veias safenas.
O exame macroscópico deve incluir tamanho, localização e profundidade de penetração da lesão primária, além de sua distância em relação às margens de ressecção cirúrgica de pele, profunda, vaginal e perianal.
Os cortes devem incluir o tumor (que pode ser exofítico, ulcerado ou plano, mostrando a profundidade máxima de invasão), grandes e pequenos lábios, uretra distal, clitóris e margens de ressecção próximas ao tumor, incluindo a vaginal (identificada com tinta-da-china de cores diferentes) e todos os linfonodos presentes. Quando é realizada a linfadenectomia inguinofemoral, geralmente seis ou mais linfonodos estarão incluídos. Um ou mais cortes de todos os linfonodos identificados devem ser submetidos a exame histológico (dependendo da presença ou da ausência de tumor macroscópico, bem como do tamanho do linfonodo), assim como cortes para confirmar a presença ou a ausência de extensão extracapsular.
Os cortes do tumor devem incluir as margens epiteliais (vaginal e cutânea mais próxima) e profunda, além da superfície epitelial aparentemente normal ou não tumoral, na qual pode ser avaliada a presença de lesões como líquen escleroso, hiperplasia de células escamosas/líquen simples crônico ou neoplasias intraepiteliais.
Na orientação dos espécimes, a gordura inguinal é superolateral, o clitóris define a porção superior e a linha média e os grandes lábios pilificados são laterais. Lembrar que o cirurgião deve ser sempre consultado mediante eventuais dúvidas macroscópicas e, ainda, que outras lesões podem ser encontradas, devendo ser devidamente identificadas, verificadas quanto às margens de ressecção e amostradas individualmente.
4.6 Colpectomias (vaginectomias) e exenterações pélvicas
Consistem em porção variável de vagina, acompanhada de colo e corpo uterinos, podendo conter ainda bexiga (exenteração pélvica anterior), reto (posterior) ou ambos (total), estes geralmente produto do tratamento de câncer cervical (colo do útero) central recorrente.
No exame macroscópico, a vagina é aberta longitudinalmente do lado oposto ao tumor. Devem ser medidos o tamanho da lesão, a distância da margem distal e do colo e a relação com órgãos eventualmente associados. Os cortes devem mostrar a profundidade máxima de invasão tumoral, a mucosa adjacente e a margem vaginal. Os cortes perpendiculares à lesão, obtidos a partir do reto ou da bexiga, avaliam a relação do tumor com esses órgãos. Devem ser obtidos fragmentos das margens uretral, ureterais, retal proximal e distal e dos tecidos moles paravaginais.
Esquemas ou fotomacrografias, assim como em qualquer espécime excisional, podem auxiliar na interpretação do laudo.
5 Localização da lesão
Conhecer a topografia das lesões é de fundamental importância por diferentes motivos. Os carcinomas de vulva localizados próximos à linha média, por exemplo, podem estar associados a metástase linfonodal contralateral ou bilateral. Já as lesões das regiões do clitóris e dos pequenos lábios geralmente estão associadas a pior prognóstico, possivelmente relacionado às características histopatológicas, sendo geralmente encontrados nessas topografias os subtipos não relacionados ao HPV.
Por outro lado, nas lesões vaginais é importante, por exemplo, descartar envolvimento secundário de lesões cervicais principalmente nos tumores localizados nos dois terços superiores da vagina. Os CECs relacionados ao HPV geralmente surgem nos dois terços superiores da vagina, enquanto os não relacionados ao HPV tendem a se localizar no terço inferior. Carcinomas mucinosos do tipo intestinal se localizam geralmente na parede posterior baixa, adenocarcinoma mesonéfrico nas paredes laterais e carcinoma de células claras não relacionado ao HPV, mas sim ao dietilestilbestrol, nos dois-terços superiores.
6 Tipo histológico
A classificação histológica deve seguir a última Classificação dos Tumores do Trato Genial Feminino da Organização Mundial da Saúde, atualmente em vigor a 5ª edição, 2020.
7 Grau histológico
Diferentes sistemas de graduação podem ser adotados, incluindo os que avaliam, por exemplo, o infiltrado inflamatório e a presença de invasão vascular. No entanto, não há consenso na literatura sobre a reprodutibilidade e valor prognóstico desses sistemas. Na tentativa de uniformização, pode-se adotar a classificação em GX (grau não avaliável), G1 (bem diferenciado), G2 (moderadamente diferenciado) e G3 (pouco diferenciado) para os carcinomas que exibem diferenciação escamosa ou glandular.
8 Dimensões tumorais
As dimensões tumorais são importantes como fator prognóstico, para o estadiamento e manejo terapêutico das pacientes.
Para as lesões vulvares, a máxima dimensão horizontal é a maior medida realizada paralela à superfície da pele. A profundidade de invasão também deve ser realizada e será discutida adiante. O laudo anatomopatológico deve conter apenas um valor para as dimensões da lesão, sendo realizado através da correlação com os dados macro e microscópicos.
9 Invasões angiolinfática e perineural
Para os carcinomas de vulva a invasão angiolinfática é um fator prognóstico adverso relacionado a alto risco de recorrência local, metástase linfonodal e pior sobrevida no caso de carcinoma de células escamosas. Para as lesões de vagina, seu valor prognóstico ainda é controverso. No entanto, recomenda-se avaliação e relato de invasões angiolinfáticas nos dois casos. O uso de marcadores imuno-histoquímicos para endotélio e vasos linfáticos como CD31, CD34 e D2-40 pode ser valioso nos casos de dificuldade de interpretação ao H&E. Já a invasão perineural está associada com menor sobrevida global e livre de doença nos pacientes com CEC de vulva, além de ser um fator preditor independente de recorrência local.
10 Margens de ressecção cirúrgica
Secções apropriadas devem ser realizadas para inclusão da margem epitelial/ de mucosa periférica e profunda mais próximas. Recomenda-se que as margens cirúrgicas sejam pintadas e que algumas recomendações sejam seguidas:
– Margens cirúrgicas comprometidas devem ser especificadas, bem como a distância da margem mais próxima.
– Quando comprometida, a margem de ressecção cirúrgica lateral deve ser perpendicular à superfície da mucosa/pele, incluindo superfície epitelial e partes moles da profundidade.
– A margem lateral deve ser medida a partir da borda estromal periférica ou da borda da superfície epitelial, a que for mais próxima.
– A medida da margem mais próxima deve ser feita preferencialmente com uma linha interrupta; no entanto, algumas situações (“colarete”), permite-se mensurar através da somatória das medidas de diferentes linhas.
– O comprometimento das margens por lesões precursoras de alto grau deve ser reportado com especificação da margem. Também é recomendado que se faça a medida da margem até a lesão precursora, como forma de facilitar a coleta de dados para futuros estudos que objetivem estudar a correlação dessa medida com outras características clínico-patológicas. O uso da marcação imuno-histoquímica para p53 pode contribuir na análise do comprometimento por lesão intraepitelial vaginal não relacionada ao HPV.
– A distância da margem profunda também deve ser reportada. Nos casos em que a margem profunda é irregular a menor distância entre o tumor e a margem pode não ser correspondente ao ponto de maior infiltração, e isso deve ser levado em consideração ao se reportar essa medida.
11 Análise dos linfonodos
É necessário identificar o sítio anatômico e a quantidade de linfonodos examinados, além do número de linfonodos comprometidos, o tamanho do maior depósito tumoral e a presença ou ausência de extensão extranodal. Para os linfonodos macroscopicamente comprometidos por neoplasia, podem-se fazer cortes representativos. Os linfonodos que não são suspeitos ao exame macroscópico, devem ser seccionados de forma seriada em intervalos de 2,0 mm perpendicularmente ao eixo axial e submetidos inteiramente a exame histológico. Para os linfonodos sentinelas, deve-se seguir protocolo definido de forma multidisciplinar em cada instituição, incluindo, por exemplo, uso ou não de exame imuno-histoquímico com citoqueratinas para detecção de metástases.
12 Estudos complementares
Imunohistoquímica para p16 e testes pra detecção direta de produtos do HPV
É indispensável nos casos de carcinoma de células escamosas para definição da associação ou não com HPV devido a implicações prognósticas. Se realizados em biópsias, não é necessário repetir na peça cirúrgica, nem em casos de recorrência tumoral.
O p16 é uma proteína celular geralmente superexpressa nas infecções por HPV. Sua marcação imuno-histoquímica em padrão bloco (forte e difusa) nos carcinomas de células escamosas é necessária para correlação com o HPV e tem boa acurácia, sendo fator prognóstico. Idealmente, esse método deve ser realizado em conjunto com os testes de detecção direta do DNA e mRNA do HPV. No entanto, são observadas algumas discrepâncias entre os resultados quando os dois testes são aplicados, além de que a maioria dos laboratórios só tem acesso aos testes imuno-histoquímicos. Mesmo testes de reação em cadeia da polimerase (PCR) e hibridização in situ possuem limitações.
O padrão em bloco de p16 para os casos de CEC in situ é definido por uma positividade forte e difusa, nuclear e citoplasmática (menos frequentemente apenas nuclear) em todas as células epiteliais nas camadas basal e parabasal com extensão para as camadas superiores até no mínino um terço da espessura do epitélio e para no mínimo 6 camadas de células. Nos casos de CEC invasivos, ocorre positividade forte e difusa em quase todas as células, mas as áreas ceratinizadas podem ser negativas. Ao reportar o laudo com esses padrões de marcação, deve-se utilizar os termos padrão bloco, “anormal” ou “aberrante”.
Imuno-histoquímica para p53
Em geral, as lesões vulvares e vaginais associadas ao HPV e as lesões precursoras de alto grau exibem padrão selvagem de marcação imuno-histoquímica para p53. Por outro lado, muitas lesões escamosas não relacionadas ao HPV exibem padrão de expressão aberrante. Alguns estudos têm mostrado que as lesões TP53 selvagem possuem melhor prognóstico que as TP53 mutadas. A marcação para p53 pode auxiliar na análise do comprometimento de margens por neoplasias intraepiteliais vaginais, sendo que o padrão aberrante corrobora para esse comprometimento.
Outros marcadores imuno-histoquímicos
Adenocarcinomas tipo intestinal podem ser positivos para CK20 e CDX2. Carcinomas mesonéfricos por sua vez podem apresentar positividade para GATA3, CD10 e TTF1. Carcinoma de células claras podem ser tipicamente positivos para Napsina A e Hepatocyte (fator nuclear 1-beta). Adenocarcinomas da glândula de Skene geralmente são positivos para marcadores prostáticos (PSA, fosfatase ácida prostática, NKX3.1).
Outros biomarcadores como o PD-L1 podem ser futuramente incorporados na análise da predição de resposta a tratamentos com uso de inibidores de chekpoints imunológicos.
13 Fatores Prognósticos
Vulva
- Tamanho do tumor.
• Profundidade de invasão tumoral.
• Invasão angiolinfática.
• Número de linfonodos envolvidos e tamanho das metástases linfonodais.
• Extensão extranodal.
A frequência de metástases linfonodais aumenta quando a profundidade de invasão excede 1 mm. A presença de invasão linfovascular tem sido associada com pior prognóstico e é fator de risco de metástase linfonodal regional.
Em alguns estudos, o padrão infiltrativo de invasão é associado com a frequência maior de metástases linfonodais. O risco de recorrência parece ser maior no carcinoma ceratinizante quando comparado aos carcinomas basaloide e condilomatoso. Já o grau de diferenciação, ploidia de DNA, superexpressão de p53, status de pRb, análise de fração S e idade não são fatores uniformemente identificados como de importância prognóstica.
Vagina
- Profundidade de invasão.
• Extensão locorregional.
• Metástases.
* Nota: Tumores superficialmente invasivos (até 3 mm de profundidade) estão associados à baixa frequência de metástases linfonodais regionais.
14 Mudanças na interpretação e classificação das alterações epiteliais não neoplásicas/dermatoses vulvares (ISSVD/ISGYP)
- A hiperplasia de células escamosas é atualmente considerada líquen simples crônico.
• A distrofia mista é atualmente considerada líquen escleroso (classificado “padrão de homogeinização/esclerose dérmica” na nova classificação das dermatoses vulvares) associado a líquen simples crônico (classificado “padrão acantótico” na nova classificação das dermatoses vulvares), variável.
15 Subtipos histológicos de NIV
- NIV usual (NIV-u) bowenoide – superfície espiculada, hiperqueratótica, núcleos grandes e pleomórficos, multinucleação, disqueratose de células isoladas, mitoses atípicas e coilocitose.
• NIV usual (NIV-u) basaloide – queratinização discreta, células uniformes pequenas, núcleos hipercromáticos sem nucléolos, mitoses frequentes.
• NIV usual (NIV-u) misto – lesão com morfologia mista bowenoide e basaloide.
• NIV diferenciado (NIV-d) – maturação precoce, células escamosas grandes com citoplasma eosinófilo volumoso, núcleos vesiculares e nucléolo proeminente, atipia basal, pontes intercelulares evidentes.
• NIV não classificado – quando o padrão morfológico não se encaixa nas categorias citadas.
A classificação de NIV em graus 1, 2 e 3 é utilizada para lesões associadas à infecção por HPV. O termo NIV usual se aplica a NIV2 e a NIV3. O NIV diferenciado não é graduado (por definição, é grau 3). A frequência de progressão para lesão invasiva é maior no NIV diferenciado do que no NIV usual. Apesar de a proposta da ISSVD (há quase 10 anos) de se abolir o termo NIV1, ele ainda é utilizado rotineiramente.
16 Classificação da doença de Paget da vulva (Wilkinson e Brown)
- Tipo 1: Doença de Paget primária da pele.
- 1A: Puramente intraepitelial.
• 1B: Primária intraepitelial com invasão.
• 1C: Associada a adenocarcinoma vulvar subjacente. - Tipo 2: Doença de Paget como manifestação de adenocarcinoma adjacente não cutâneo (anal, retal, cervical [uterina], etc.).
• Tipo 3: Neoplasia intraepitelial urotelial pagetoide (PUIN) – pseudo-Paget relacionado a carcinoma urotelial.
17 Imuno-histoquímica em lesões vulvares
Como já referido, as NIV-u e os carcinomas associados à infecção por HPV de alto risco geralmente exibem positividade forte e difusa para p16 (nuclear e/ou citoplasmática) na maioria dos casos. Já as NIV-d e os carcinomas associados geralmente exibem positividade para p53 (que não é específica para estas lesões) na camada basal, de padrão contínuo e se estendendo para as camadas suprabasais.
Tabela 4 Imuno-histoquímica da doença de Paget.
| CK7 | CK20 | GCDFP-15 | CEA | UP-III | |
| Neoplasia primária da pele | + | – | + | + | – |
| Relacionada a carcinoma anorretal | + | + | – | + | – |
| Relacionada a carcinoma urotelial (PUIN) | + | (+) | – | – | + |
UP-III: uroplaquina III; GCDFP-15: proteína do fluido da doença cística macroscópica – 15; melanoma: S100, HMB-45 e melan-A (+); PUIN: pagetoid urothelial intraepithelial neoplasia.
1 Medida de profundidade de invasão e de espessura tumoral (Figura 1)
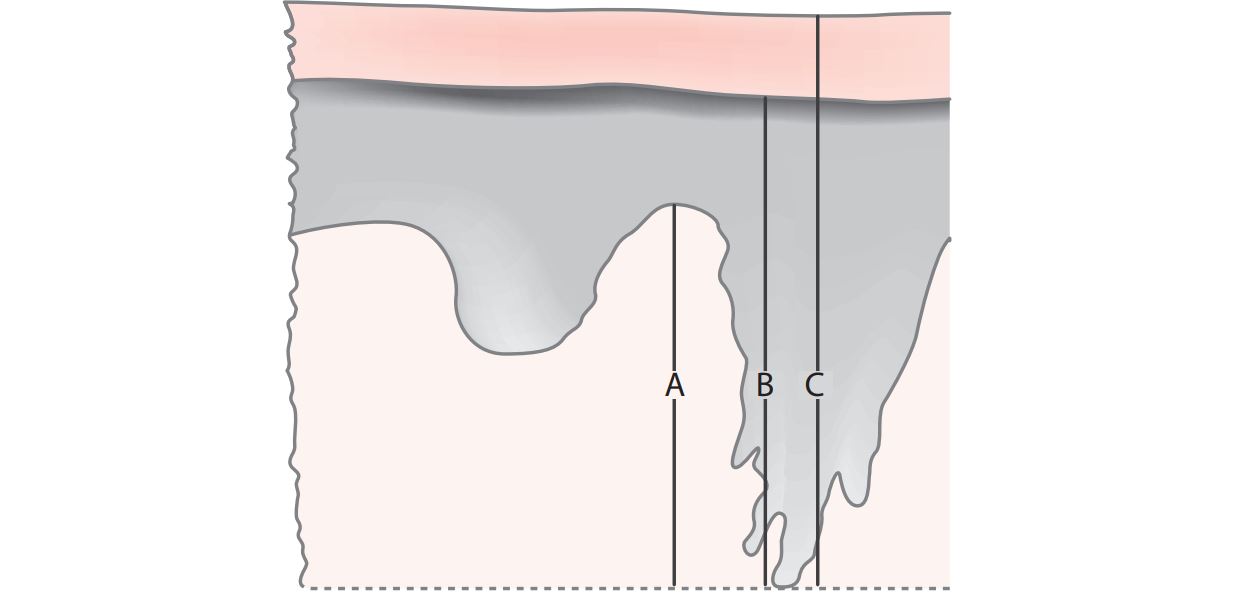
Figura 1 Medida de profundidade e de espessura tumoral do carcinoma invasivo da vulva.
Recomenda-se, para a medida da profundidade de invasão, o método ilustrado em “A”, definido como a medida do da junção epitelial-estromal da papila dérmica mais superficial adjacente até o ponto mais profundo de invasão tumoral. As demais formas de medidas carecem de mais estudos prospectivos com casuísticas mais robustas para serem aplicadas na rotina diagnóstica para uso clínico.
19 Esquema de macroscopia – vulvectomia radical com linfadenectomia inguinofemoral (Figura 2)
- Dissecção da gordura inguinal (linfonodos).
- Corte do clitóris e da margem vaginal anterior.
- Corte dos lábios maior e menor contralaterais.
- Fúrcula e margem perineal.
- Lesão e margem cutânea mais próxima.
- Lesão e margens vaginal e profunda mais próximas.
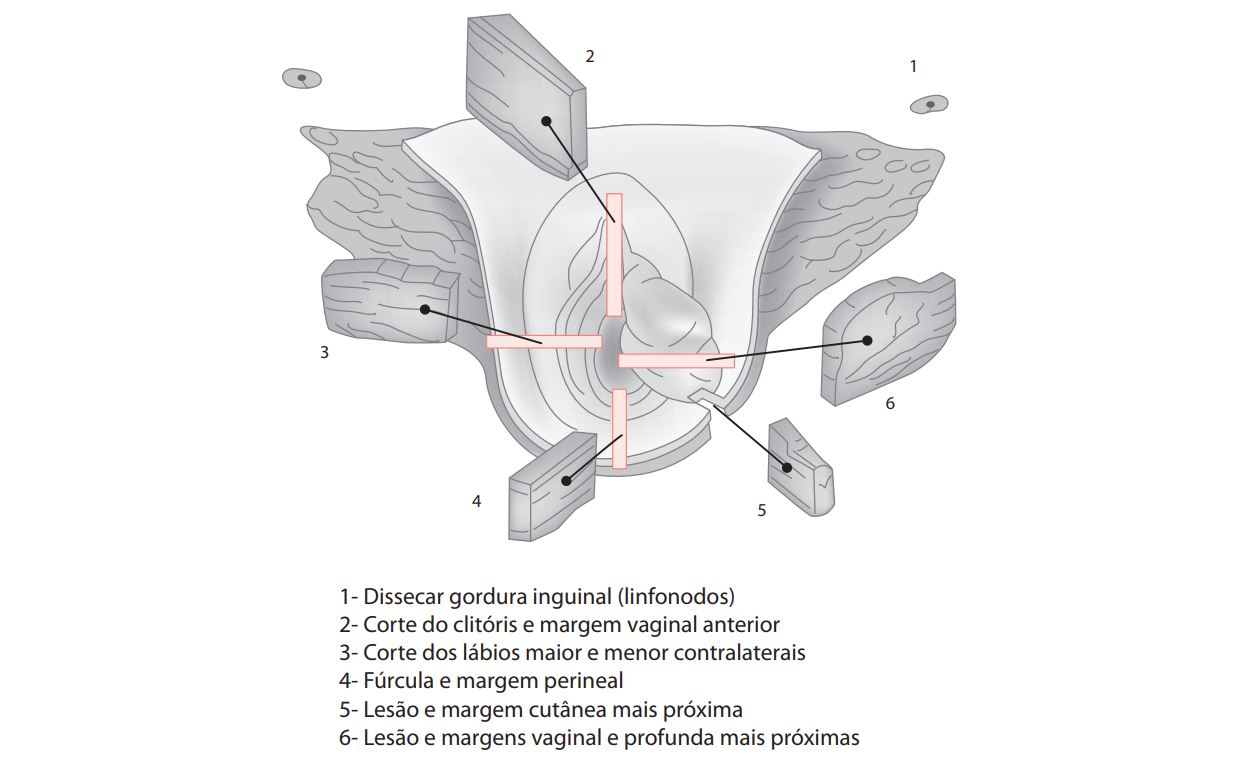
Figura 2
20 Exame intraoperatório de congelação e linfonodo-sentinela
O exame intraoperatório de congelação não é rotineiramente executado para a avaliação de margens de lesões. Já a avaliação intraoperatória de linfonodo-sentinela não é recomendada na rotina em razão de potenciais erros associados de amostragem e interpretação. Se o exame intraoperatório for realizado, os fragmentos congelados devem ser submetidos a exame histológico.
Bibliografia
AJCC Cancer Staging Handbook: from the AJCC Cancer Staging Manual. 8. ed. New York: Springer, 2016.
Brown L, McCluggage WG (eds.). Standards and datasets for reporting cancers. Datasets for the histopathological reporting of vulval neoplasms. 3. ed. London: The Royal College of Pathologists, 2010.
College of American Pathologists (CAP). Protocol for the Examination of Specimens from Patients with Carcinoma of the Vagina. 2012. Disponível em: https://documents.cap.org/protocols/Vagina_4.3.0.0.REL_CAPCP.pdf; acessado em: 28 de outubro de 2021.
College of American Pathologists (CAP). Protocol for the Examination of Specimens from Patients with Carcinoma of the Vulva. 2011. Disponível em: https://documents.cap.org/protocols/Vulva_4.2.0.1.REL_CAPCP.pdf; acessado em: 28 de outubro de 2021.
WHO Classification of Tumours Editorial Board. Female Genital Tumours. Lyon (France). International Agency for Research on Cancer; 2020. WHO Classification of tumour series; 5a. ed; vol.4.
McCluggage WG, Bosse T, Focchi G, Gilks CB, Hoang L, Howitt BE, Ordi J, Singh N, Wong R, McAlpine J, Lax SF (2021). Carcinoma of the Vagina Histopathology Reporting Guide. International Collaboration on Cancer Reporting; Sydney, Australia. ISBN: 978-1-922324-21-4.
McCluggage WG, Bosse T, Focchi G, Gilks CB, Hoang L, Howitt BE, Ordi J, Singh N, Wong R, McAlpine J, Lax SF (2021). Carcinoma of the Vulva Histopathology Reporting Guide. International Collaboration on Cancer Reporting; Sydney, Australia. ISBN: 978-1-922324-22-1.
Carvalho FM (ed.). Alterações epiteliais escamosas não neoplásicas e neoplasias da vulva. Manual de padronização de laudos histopatológicos – Sociedade Brasileira de Patologia. 2. ed. São Paulo: Reichmann e Affonso, 1999.
Domizio P, Lowe D (eds.). Reporting Histopathology Sections. London: Chapman & Hall Medical, 1997.
Hirschowitz L, Nucci M, Zaino RJ. Problematic issues in the surgical staging of endometrial, cervical and vulval carcinomas. Histopathology 2013; 62:176-202.
Hruban RH, Westra WH, Phelps TH, Isacson C (eds.). Surgical pathology dissection – an illustrated guide. 2. ed. New York; Springer, 2003.
Kurman RJ (ed.). Blaustein’s pathology of the female genital tract. 6. ed. New York: Springer, 2011.
Lester SC (ed.). Manual of surgical pathology. 3. ed. Philadelphia: Saunders, 2010.
Lynch PJ, Moyal-Barroco M, Bogliotto F. ISSVD classification of vulvar dermatoses: pathologic subsets and their clinical correlates. J Reprod Med 2007; 52(1):3-9.
McCluggage WG. Recent developments in vulvovaginal pathology. Histopathology 2009; 54:156-73.
Pirog EC. Pathology of vulvar neoplasms. In: Soslow R (ed.). Current concepts in gynecologic pathology: epithelial tumors of the gynecologic tract. surgical pathology clinics. New York: Saunders, 2011.
Reichert RA (ed.). Diagnostic gynecologic and obstetric pathology: an atlas and text. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2012.
Robboy SJ, Anderson MC, Russell P (eds.). Pathology of the female reproductive tract. 2. ed. London: Churchill Livingstone, 2008.
Rosai J (ed.). Rosai and Ackerman’s surgical pathology. 9. ed. Saint Louis: Mosby, 2004.
Silverberg SG (ed.). Diagnostic problems in gynecologic pathology. California Tumor Tissue Registry. 115th Semi-Annual Seminar. December 7, 2003. San Francisco, CA. Tavassoli FA, Deville P (eds.). World Health Organization Classification of Tumors. Pathology and genetics: tumours of the breast and female genital organs. Lyon: IARC Press, 2003.
Voltar para a página inicial do manual
