Gustavo Rubino de Azevedo Focchi
Renata de Marchi Triglia
João Norberto Stávale
Códigos de topografia
C54 Neoplasia maligna do corpo do útero
C54.1 Endométrio
C54.8 Lesão invasiva do corpo do útero
C54.9 Corpo do útero, não especificado
I. Identificação e resumo clínico
II. Dados clínicos relevantes
III. Procedimento cirúrgico
- Histerectomia supracervical/subtotal
- Histerectomia simples
- Histerectomia ampliada
- Ooforectomia direita
- Ooforectomia esquerda
- Ooforectomia bilateral
- Salpingectomia direita
- Salpingectomia esquerda
- Salpingectomia bilateral
- Salpingo-ooforectomia direita
- Salpingo-ooforectomia esquerda
- Salpingo-ooforectomia bilateral
- Omentectomia
- Útero morcelado
- Biópsia peritoneal
- Outro (especificar) _______________
- Não especificado
- Linfadenectomia
- Realizada
- Linfonodos pélvicos
- Linfonodos para-aórticos
- Outros linfonodos (especificar) _______________
- Não realizada
IV. Exame macroscópico
Orientar a peça usando pontos anatômicos, como reflexão peritoneal mais alta (anteriormente) e mais baixa (posteriormente), além do posicionamento dos ligamentos redondos (anteriormente), ovários (posteriormente) e tubas uterinas (posição intermediária).
Tamanho e peso do espécime ___ x ___ x ___ cm e _____ g
Tumor
Tamanho ____ cm (maior dimensão)
Localização
- Unifocal
- Multifocal
- Endométrio anterior
- Endométrio posterior
- Outra (especificar) _______________
Características
- Aparência
- Sólido
- Papilífero
- Ulcerado
- Necrótico
- Hemorrágico
- Cor
- Extensão: presença de comprometimento miometrial (se acomete menos ou mais da metade da espessura do miométrio), serosa, paramétrio, colo uterino, tubas uterinas e ovários
Descrição macroscópica das demais estruturas que acompanham o útero: ovários, tubas uterinas, etc.
Linfonodos
- Ausentes
- Presentes (especificar número e dimensões do maior linfonodo)
V. Processamento macroscópico (Figura 1)
Além dos procedimentos de rotina, é preciso lembrar-se de:
- Pintar os tecidos moles em torno do colo uterino e tecidos para-uterinos / paramétrios.
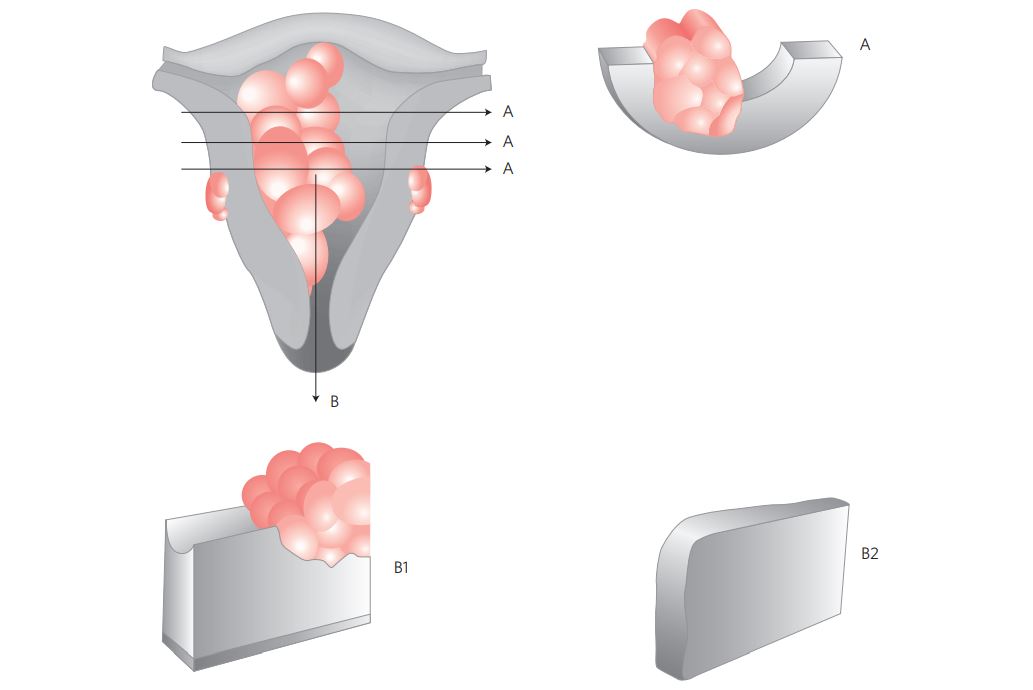
Figura 1 Processamento macroscópico do carcinoma do endométrio.
- Observar se há envolvimento neoplásico da serosa, colo uterino, tecidos para-uterinos/paramétrios e anexos.
- Abrir o útero longitudinalmente, ao longo das paredes uterinas laterais ( 3 e 9 hs) dividindo-o em 2 metades (anterior e posterior) e fixá-lo; seccionar cada metade do corpo uterino de modo seriado com cortes transversais a cada 1 cm, localizando a área de maior profundidade de infiltração tumoral e coletando amostra deste ponto, além de mais três secções do tumor (total: 4 secções). Realizar cortes transversais procurando representar o tumor e toda a espessura miometrial, até a serosa.
- Incluir a transição do tumor com o endométrio íntegro.
- Incluir amostras (duas) do endométrio não neoplásico.
- Seccionar longitudinalmente o canal cervical (do colo do útero), representando o limite endométrio-colo uterino superiormente e a transição ectoendocervical inferiormente.
- Representar os tecidos para-uterinos / paramétrios especialmente no caso de comprometimento ístmico e/ou cervical (do colo do útero).
- Seccionar transversalmente ovários e tubas uterinas (se aplicável); incluir amostras de ambos.
- Representar os linfonodos separadamente, de acordo com a localização (se aplicável), com cortes paralelos de 2-3 mm, perpendiculares ao maior eixo (submeter preferencialmente apenas 1 linfonodo por cassete).
Nota: 1) O endométrio sofre autólise rapidamente, caso o útero não seja aberto e fixado logo após a cirurgia.
2) Identificar cada bloco para facilitar revisões externa ou interna e estudos imunohistoquimicos ou moleculares
VI. Exame microscópico
VI.1 Tipo histológico (Organização Mundial da Saúde [OMS])
- Carcinoma endometrioide sem outra especificação
- Carcinoma endometrioide, variante (especificar com diferenciação escamosa, mucinosa, viloglandular, secretora, células ciliadas)
- Carcinoma mucinoso
- Carcinoma seroso
- Carcinoma de células claras
- Carcinoma misto (especificar tipos e porcentagens; somente deve ser usado se 2 ou mais subtipos distintos de adenocarcinoma de endométrio forem identificados, cada um representando mais de 10% do tumor)
- Carcinoma escamoso
- Carcinoma transicional
- Carcinoma de pequenas células
- Carcinoma indiferenciado
- Carcinossarcoma/tumor mulleriano misto maligno
- Outro (especificar) _____________
VI.2 Grau histológico
International Federation of Gynecology and Obstetrics (FIGO): aplica-se somente a adenocarcinomas endometrioide e mucinoso:
- Grau 1 (até 5% de áreas sólidas não morulares/não escamosas).
- Grau 2 (6 a 50% de áreas sólidas não morulares/não escamosas).
- Grau 3 (> 50% de áreas sólidas não morulares/não escamosas).
Nota 1: É recomendável a graduação utilizando-se critérios tanto arquiteturais quanto nucleares. O grau nuclear é determinado pela variação de tamanho e forma dos núcleos, distribuição da cromatina e tamanho do nucléolo: o grau 1 nuclear é definido por núcleos ovais levemente aumentados de tamanho, com cromatina homogeneamente dispersa; o grau 3 nuclear é definido por núcleos intensamente aumentados e pleomórficos, com cromatina irregularmente distribuída e nucléolos eosinofílicos proeminentes. Tumores que apresentam grau arquitetural 1 ou 2 devem ser graduados como grau FIGO G2 ou G3, respectivamente, apenas quando o grau nuclear for 3 difusamente pelo tumor e após excluir tratar-se de carcinoma seroso.
Nota 2: Lembrar que nos carcinomas com diferenciação escamosa, a graduação é baseada no componente glandular.
Para os demais carcinomas:
- G1 – Bem diferenciado
- G2 – Moderadamente diferenciado
- G3 – Pouco diferenciado
- Não aplicável
Carcinomas seroso , de células claras e indiferenciado são considerados de alto grau histológico (está subentendido, não sendo necessário mencionar no laudo).
VI.3 Invasão miometrial
- Não identificada
- Presente
Nota: Se a profundidade exata de invasão miometrial não puder ser determinada, registrar.
VI.4 Comprometimento do colo uterino
- Ausente
- Presente (especificar)
- Apenas envolvimento da mucosa endocervical
- Invasão do estroma cervical (pT2)
VI.5 Comprometimento de outras estruturas: ovário(s), tuba(s) uterina(s), vagina, paramétrio, omento, parede retal, parede vesical, parede pélvica, outra(s)
VI.6 Líquido ascítico/lavado peritoneal
- Negativo para malignidade
- Suspeito para malignidade
- Positivo para malignidade
- Insatisfatório: informar o motivo
Nota: Não altera o estadiamento, mas é importante mencionar.
VI.7 Margens
- Não avaliáveis
- Livres de neoplasia: registrar a distância da margem mais próxima (mm)
- Comprometida pela neoplasia: especificar a margem
Nota: O tecido mole paracervical é a única margem verdadeira em espécimes de histerectomia total e sua situação não é normalmente referida. Relatar a situação das margens vaginal e para-uterina/parametrial é opcional. Apesar de não ser margem, é importante referir o comprometimento da serosa uterina, quando esta existir (pT3a).
VI.8 Invasão linfovascular
- Não identificada
- Presente
- Indeterminada
VI.9 Linfonodos
Informar o número total de linfonodos identificados para cada região topográfica e o número de linfonodos comprometidos.
VI.10 Demais estruturas avaliadas (endométrio adjacente/não neoplásico, miométrio, anexos, etc.)
Listar diagnósticos histológicos.
VI.11 Exame de congelação
- Não realizado
- Realizado (especificar)
- Tipo e grau da neoplasia (endometrioide vs. não endometrioide; alto grau vs. FIGO G1 ou G2)
- Profundidade de invasão miometrial (ausente ou menos do que 50% vs. maior ou igual a 50% da espessura miometrial)
- Avaliar o comprometimento de istmo/colo uterino
- Comprometimento linfonodal
- Comprometimento anexial
VII. Diagnóstico final (exemplo)
Produto de histerectomia e salpingo-ooforectomia bilateral: carcinoma endometrioide grau 2 (FIGO), com invasão de 70% da espessura miometrial. Presença de invasão linfovascular. Endométrio adjacente à neoplasia com hiperplasia complexa com atipia. Colo uterino, ovários e tubas uterinas livres de neoplasia. Presença de metástases em 1/4 linfonodos pélvicos e em 2/3 linfonodos para-aórticos.
Estadiamento patológico pTNM: pT1b, pN2, pM0.
Estadiamento Figo: IIIC2.
VIII. Comentários
VIII.1 Estadiamento patológico pTNM [Figo]
pT – Tumor primário
- pTX – O tumor primário não pode ser avaliado
- pT0 – Sem evidências de tumor primário
- pT1a [IA] – Tumor limitado ao endométrio ou invade menos da metade da espessura do miométrio
- pT1b [IB] – Tumor invade 50% ou mais da espessura do miométrio
- pT2 [II] – O tumor invade o tecido conectivo estromal do colo uterino, mas não se estende além do útero
- pT3a [IIIA] – O tumor compromete a serosa e/ou o anexo (extensão direta ou metástase)
- pT3b [IIIB] – Comprometimento vaginal (extensão direta ou metástase) ou envolvimento parametrial
- pT4 [IVA] – O tumor invade a mucosa vesical e/ou mucosa intestinal
pN – Linfonodos regionais (pN)
- pNX – Não pode ser avaliado
- pN0 – Ausência de metástases em linfonodos regionais
- pN0(i+): células tumorais isoladas em linfonodo(s) regionais menor que 0,2 mm
- pN1: Metástases em linfonodos pélvicos
- pN1mi: metástases em linfonodos regionais ( maior que 0, 2 mm mas menor que 2 mm em diâmetro) para linfonodos pélvicos
- pN1a: metástases em linfonodos regionais (maior que 2 mm em diâmetro) para linfonodos pélvicos
- pN2: Metástases em linfonodos para-aórticos, com ou sem comprometimento de linfonodos pélvicos
- pN2mi: metástases para linfonodos regionais ( maior que 0,2 mm mas menor que 2 mm em diâmetro) para linfonodos para-aórticos, com ou sem linfonodos pélvicos positivos.
- pN2a: Metástases em linfonodos regionais ( maior que 2 mm em diâmetro) para linfonodos para-aórticos, com ou sem linfonodos pélvicos positivoNota: Mesmo uma metástase maior que 2 mm deve ser classificada como pN1a e pN2a
pM – Metástases a distância
- pM0 – Ausência de metástases a distância
- pM1 [IVB] – Metástases a distância (inclui linfonodos inguinais, doença intraperitoneal e metástases pulmonar, hepática ou óssea. Exclui metástases para linfonodos para-aórticos, vagina, serosa pélvica e/ou anexos)
VIII.2 Grupos prognósticos
Tabela 1 Grupos prognósticos do carcinoma do endométrio.
| Estádio | T | N | M |
| Estádio 0 | Tis | N0 | M0 |
| Estádio IA | T1a | N0 | M0 |
| Estádio IB | T1b | N0 | M0 |
| Estádio II | T2 | N0 | M0 |
| Estádio IIIA | T3a | N0 | M0 |
| Estádio IIIB | T3b | N0 | M0 |
| Estádio IIIC1 | T1-T3 | N1/ Ni1mi/Nia | M0 |
| Estádio IIIC2 | T1-T3 | N2/N2mi/N2a | M0 |
| Estádio IVA | T4 | Qualquer N | M0 |
| Estádio IVB | Qualquer T | Qualquer N | M1 |
IX. Considerações gerais
IX.1 Estudo imuno-histoquím
O estudo imuno-histoquímico pode ser empregado com a finalidade de definir se o adenocarcinoma tem origem endometrial ou endocervical, Nessa situação, em tumores bem a moderadamente diferenciados, os marcadores mais indicados são: P16, receptores de progesterona e estrógeno, vimentina e CEA (monoclonal). Os adenocarcinomas de origem endometrial de baixo grau (FIGO G1 e G2) são usualmente positivos para vimentina e receptores hormonais e negativos para CEA; os adenocarcinomas de origem endocervical são geralmente positivos para CEA e negativos para vimentina e receptores hormonais (especialmente progesterona). A expressão de P16, marcador associado à presença de HPV de alto risco e, portanto, indicativa de origem endocervical, pode ser útil também nessa situação; porém, o resultado também pode ser positivo em adenocarcinomas de alto grau do endométrio, principalmente em carcinoma endometrioide FIGO grau 3, carcinoma seroso e carcinoma de células claras (os quais também exibem mais frequentemente negatividade para receptores hormonais). Em adenocarcinomas uterinos de alto grau histológico, os padrões imuno-histoquímicos de expressão de P53 possuem maior valor na distinção entre origem cervical (padrão mais frequentemente não aberrante) ou endometrial (padrão mais frequentemente aberrante).
Outra situação em que a imuno-histoquímica pode ser empregada é na investigação de síndrome de Lynch, de herança autossômica dominante, que está associada não só ao desenvolvimento de câncer colorretal, mas também de carcinoma de endométrio, especialmente em pacientes mais jovens. O carcinoma de endométrio associado à síndrome de Lynch tende a ser mais agressivo que o carcinoma esporádico. Os marcadores empregados nessa investigação são proteínas relacionadas aos genes de reparo de DNA: MLH1, MSH2, MSH6 e PMS2. Atualmente, recomenda-se realização de imuno-histoquímica para pesquisa da expressão destas proteínas (MSH6 e PMS2 inicialmente, com avaliação dos respectivos pares se indicada) para todos os carcinomas endometriais.
As características morfológicas que podem, mais frequentemente, estar associadas à síndrome de Lynch são presença de componente de carcinoma indiferenciado, infiltrado linfocitário denso peritumoral, heterogeneidade tumoral (p. ex., componente de carcinoma indiferenciado e de endometrioide grau 1) e tumores centrados no segmento uterino inferior.
IX.2 Patologia molecular
A pesquisa de HPV por métodos moleculares (particularmente PCR) pode ser útil na definição da origem do adenocarcinoma (endometrial versus endocervical), uma vez que o HPV é raramente detectado em adenocarcinomas de origem endometrial.
A investigação complementar para síndrome de Lynch – após triagem inicial por imuno-histoquímica como anteriormente referido – é realizada por métodos moleculares (determinação do status de metilação do promotor de MLH1 em casos com perda da imunoexpressão de MLH1 e PMS2; PCR para instabilidade de microssatélites; análise de mutações dos genes MLH1, PMS2, MSH2 e MSH6).
A determinação do subgrupo genômico do carcinoma endometrial (ultramutado, hipermutado, alto número de cópias, baixo número de cópias / sem perfil específico) tem mostrado relevância clínica, especialmente em tumores de alto grau histológico. Cabe aqui ressaltar que carcinomas endometrioides FIGO G3 são heterogêneos no que se refere ao perfil genômico, o que significa na prática que tumores de morfologia similar podem exibir prognósticos muito distintos. Carcinomas do subgrupo com mutação do gene da polimerase épsilon (POLE), apesar de frequentemente exibirem alto grau histológico, morfologia ambígua e áreas de morfologia que remete a carcinoma seroso, possuem o prognóstico mais favorável. Carcinomas do subgrupo associado a instabilidade de microssatélites podem mostrar aspectos morfológicos superponíveis aos carcinomas relacionados a mutação da POLE (incluindo numerosos linfócitos peri- e intra-tumorais); pacientes destes dois subgrupos genômicos podem ser beneficiadas pela imunoterapia. Já carcinomas do subgrupo de alto número de cópias, representados em sua maior parte por carcinomas serosos, e caracterizados pela mutação de P53, possuem o pior prognóstico. A determinação do subgrupo genômico pode ser realizada através da análise de mutações do gene da POLE (para caracterização do subgrupo ultramutado) e imuno-histoquímica para P53 (que pode ser utilizada como alternativa ao método de análise mutacional do gene na caracterização do subgrupo de alto número de cópias), MSH6 e PMS2 (que podem ser utilizadas como alternativa ao método de análise de instabilidade de microssatélites, na caracterização do subgrupo hipermutado).
IX.3 Componente de carcinoma seroso
Mesmo que o componente de carcinoma seroso papilífero seja inferior a 10%, este deve ser mencionado, em razão do comportamento mais agressivo.
IX.4 É importante procurar diferenciar invasão miometrial de envolvimento de junção endomiometrial irregular ou adenomiose pelo carcinoma e também identificar padrão de mioinvasão “MELF” (formação de estruturas neoplásicas alongadas, fragmentadas e microcísticas), associado a frequência significativa de metástases linfonodais, particularmente micrometástases com células histiocitoides.
X.Bibliografia
Amin MA (editor-in-chief). AJCC Cancer Staging Manual. 8. ed. New York: Springer, 2017.
Bartosch C, Manuel Lopes J, Oliva E. Endometrial carcinomas: a review emphasizing overlapping and distinctive morphological and immunohistochemical features. Adv Anat Pathol 2011; 18:415-37.
Cho KR, Cooper K, Croce S et al. International Society of Gynecologic Pathologists (ISGyP) Endometrial cancer Project: Guidelines From the Special Techniques and Ancillary Studies Group. Int J Gynecol Pathol 2019; 38, S114-22.
Folken AK, Longacre TA. Hereditary gynaecological malignancies: advances in screening and treatment. Histopathology 2013; 62:2-30.
Hirschowitz L, Nucci M, Zaino RJ. Problematic issues in the staiging of endometrial, cervical and vulval carcinomas. Histopathology 2013; 62:176-202.
Kurman RJ, Ellenson LH, Ronnett BM. Blaustein’s pathology of the female genital tract. 6. ed. New York: Springer, 2011.
Kurman RJ, Carcangiu ML, Herrington CS, Young RH (eds.). World Health Organization Classification of Tumours: Female Reproductive System. Lyon: IARC, 2014.
Malpica A, Euscher ED, Hecht JL et al. Endometrial Carcinoma, Grossing and Processing Issues: Recommendations of the International Society of Gynecologic Pathologists. Int J Gynecol Pathol 2019; 38, S9-24.
Matias-Guiu X, Oliva E. Pathology of the endometrium. Seminars in Diagnostic Pathology 2010; 27(4):197-311.
Rosai J. Appendix E. Guidelines for handling of most common and important surgical specimens. In: Rosai J (ed.). Rosai and Ackerman’s surgical pathology. 10. ed. Philadelphia: Mosby, 2011.
Sobin LH, Gospodarowicz M, Wittekind CH (eds.). UICC TNM classification of malignant tumours. 7. ed. New York: Wiley-Liss, 2009.
Singh N, Hirschowitz L, Zaino R et al. Pathologic Prognostic Factors in Endometrial Carcinoma (Other Than Tumor Type and Grade). Int J Gynecol Pathol 2019; 38, S93-113.
Soslow RA, Tornos C, Park KJ et al. Endometrial Carcinoma Diagnosis: Use of FIGO Grading and Genomic Subcategories in Clinical Practice: Recommendations of the International Society of Gynecologic Pathologists. Int J Gynecol Pathol 2019; 38, S64-74.
Stewart CJR, Crum CP, McCluggage WG et al. Guidelines to Aid in the Distinction of Endometrial and Endocervical Carcinomas, and the Distinction of Independent Primary Carcinomas of the Endometrium and Adnexa From Metastatic Spread Between These and Other Sites. Int J Gynecol Pathol 2019; 38, S75-92.
Voltar para a página inicial do manual