Eduardo Moreira de Queiroga
Códigos de topografia
C37 Neoplasia maligna do timo
D15.0 Timo
I. Identificação e resumo clínico
II. Dados clínicos relevantes
II.1 Localização da lesão
- Mediastino anterior
- Mediastino médio
- Mediastino posterior
II.2 Sintomas associados (especificar) _____________________
II.3 História de miastenia gravis ou outro processo autoimune/paraneoplásico (especificar) ________________
II.4 História de cirurgia torácica prévia por doença neoplásica (especificar) _____________________
III. Procedimento cirúrgico
III.1 Espécime
- Timo
- Timo e outras estruturas (especificar)
- Não referido
III.2 Procedimento cirúrgico
- Timectomia
- Timectomia parcial
- Outro (especificar) ____________________
- Não referido
IV.Exame macroscópico
IV.1 Fixação do espécime
- A fresco
- Formalina a 10%
- Formalina não especificada
IV.2 Dimensões do espécime
Medidas ___ x ___ x ___ cm
IV.3 Peso ___ g
IV.4 Tamanho do tumor ___ x ___ x___ cm
IV.5 Condições da cápsula
- Presente (identificável)
- Ausente (não identificável)
- Rota
- Íntegra
IV.6 Tecidos anexos
- Gordura mediastinal
- Pleura
- Pulmão
- Parede torácica
- Pericárdio
- Outros (especificar) ______________________
IV.7 Processamento macroscópico
- Descrever a superfície da peça cirúrgica, pintar, pesar e medir o espécime em três dimensões
- Observar as estruturas anexas à peça cirúrgica (nervo, pulmão, pleura, pericárdio, etc.), descrevê-las e medi-las
- Cortar o espécime ao longo do maior eixo e, se possível, fotografar a superfície de corte
- Descrever o tumor: coloração, textura, nodularidade, necrose, septos fibrosos, hemorragia, calcificação, degeneração cística
- Identificar se há cápsula visível em torno do tumor e descrevê-la
- Observar o timo residual não neoplásico adjacente ao tumor. Quando não involuído, apresenta cor amarelada e aspecto lobulado. Se involuído, pode apresentar aspecto semelhante ao tecido adiposo
- Representação do tumor para a histologia: fazer pelo menos um cassete para cada centímetro da lesão (considerando o maior eixo do tumor). Se a superfície de corte do tumor for variegada, é recomendável fazer cortes extras para assegurar-se de que todas as áreas foram adequadamente representadas
- Se o tumor for encapsulado, é importante que a maioria dos cortes contenha o tumor e a relação com a cápsula (a superfície externa deve estar pintada)
- Se o tumor for predominantemente cístico, amostrá-lo extensamente (pelo menos dois cortes para cada centímetro da lesão), com particular atenção para as áreas sólidas, pois vários tumores do timo podem apresentar degeneração cística (incluindo seminoma, linfoma de Hodgkin, timoma, etc.)
- Fazer cortes representando as estruturas adjacentes (pleura, pericárdio, pulmão, diafragma)
- Se a peça cirúrgica apresentar timo residual, incluir fragmentos representativos
- Se algum linfonodo for identificado, anotar as medidas, localização anatômica e incluí-los na totalidade
Nota: A dissecção de linfonodos não é realizada rotineiramente em timectomias por timoma.
IV.8 Roteiro de relatório macroscópico
O espécime é recebido, fixado em formalina, a fresco ou outro, devidamente identificado, referido como “timoma ou excisão ou timectomia ou outro”, e consiste em cor, consistência, forma e massa de aspecto de partes moles que mede ___ x ___ x ___ cm. A superfície externa é lisa/macia, brilhante/irregular, multinodular/hemorrágica e contém segmento de pulmão e/ou diafragma e/ou pleura e/ou pericárdio, etc. que mede(m) ___ x ___ x ___ cm. Os cortes revelam massa bem delimitada completa ou incompletamente envolta por cápsula fibrosa que mede cm de espessura máxima. O tumor mede ___ x ___ x ___ cm, é composto por tecido cor/consistência/homogêneo variegado com lobulação/áreas de necrose/hemorragia/calcificação/degeneração cística. Uma pequena porção de tecido tímico residual é identificada na periferia da massa. Cortes representativos foram submetidos ao exame microscópico.
V. Exame microscópico
V.1 Tipo histológico
V.1.1 Timoma
- Timoma tipo A
- Timoma tipo AB
- Timoma tipo B1
- Timoma tipo B2
- Timoma tipo B3
- Outros (variantes): timoma micronodular com estroma linfoide, timoma metaplásico, timoma esclerosante, timoma microscópico, lipofibroadenoma
V.1.2 Carcinoma tímico
- Carcinoma escamoso
- Carcinoma basaloide
- Carcinoma mucoepidermoide
- Carcinoma do tipo linfoepitelioma
- Carcinoma sarcomatoide
- Carcinoma de células claras
- Adenocarcinoma
- Carcinoma do tipo NUT
- Carcinoma indiferenciado
V.1.3 Tumores Neuroendócrinos do Timo
- Carcinoide típico
- Carcinoide atípico
- Carcinoma neuroendócrino de pequenas células
- Carcinoma neuroendócrino de grandes células
- Outras variantes raras (especificar)
V.2 Extensão tumoral
- Tumor restrito ao timo
- Gordura mediastinal
- Pericárdio
- Diafragma
- Parênquima pulmonar (especificar lobo pulmonar) _____________________
- Pleura mediastinal
- Órgãos adjacentes ou estruturas (veia braquicefálica, veia cava superior, nervo frênico, parede torácica, artéria ou veia pulmonar extrapericárdica, aorta, vasos arqueados, artéria pulmonar intrapericárdica, miocárdio, traqueia, esôfago e outros)
- Outros (especificar) _____________________
V.3 Invasão angiolinfática
- Não detectada
- Detectada
V.4 Invasão perineural
- Não detectada
- Detectada
V.5 Linfonodos regionais
- Não identificados
- Ausência de metástase
- Presença de metástase
- Número de linfonodos examinados ____________________
- Número de linfonodos envolvidos ____________________
V.6 Achados patológicos adicionais
- Alterações involutivas na área de timo não neoplásico
- Fibrose
- Hiperplasia tímica folicular
- Hiperplasia tímica epitelial
- Hiperplasia tímica verdadeira
- Alteração cística no tumor
- Alteração cística no timo adjacente
- Outros (especificar) ____________________
V.7 Efeitos de tratamento
- Não aplicáveis
- Não podem ser determinados
- Presentes (especificar porcentagem de tumor residual viável)______________
V.8 Margens
- Não podem ser determinadas
- Ausência de envolvimento pelo tumor: distância do tumor para a margem mais próxima _____ mm
- Margem comprometida
Nota: A timectomia envolve dissecção e mobilização do timo do pericárdio e da pleura mediastinal. Na maior partes dos espécimes, a superfície posterior constitui a verdadeira margem cirúrgica. Essa superfície posterior da timectomia é de difícil identificação, sendo importante o contato com o cirurgião para a orientação do espécime antes de iniciar o processamento macroscópico. Alguns espécimes de timectomia apresentam ainda estruturas anexas (pleura, diafragma, pericárdio). As margens dessas estruturas devem ser identificadas pelo cirurgião e pintadas para facilitar a análise microscópica das margens cirúrgicas.
VI. Diagnóstico final (exemplo)
Produto de timectomia: timoma tipo A (OMS), medindo ___ x ___ x ___ cm, localizado no mediastino anterior. Ausência de invasão capsular. Margens cirúrgicas livres. Ausência de envolvimento neoplásico de pleura, diafragma e pericárdio. Timo residual de aspecto involutivo. Estadiamento patológico: I (classificação de Masaoka modificada).
VII. Comentários
VII.1 Estadiamento patológico dos timomas (classificação de Masaoka modificada)
- I – Tumor encapsulado (macroscópica e microscopicamente) (inclui invasão capsular parcial – não transmural)
- IIa – Invasão microscópica transcapsular
- IIb – Invasão capsular macroscópica
- III – Invasão macroscópica de órgãos adjacentes
- IVa – Disseminação pleural ou pericárdica
- IVb – Disseminação hematogênica ou linfática
- Não pode ser determinado
VII.2 Estadiamento patológico dos timomas (classificação de Moran et al., 2012)
- 0 – Tumor encapsulado
- I – Tumor invade tecido adiposo peritímico
- II – Invasão direta
- IIA – Veia inonimada, pleura mediastinal ou pulmão
- IIB – Pericárdio
- IIC – Grandes vasos (aorta, veia cava superior) ou coração
- III – Doença metastática
- IIIA – Estruturas intratorácicas (diafragma, linfonodos)
- IIIB – Estruturas extratorácicas
VII.2.1 Informações com relação à proposta de estadiamento desenvolvida por Moran et al. (2012)
- Estádio 0: timoma encapsulado é um tumor envolto por cápsula de tecido fibroconectivo e restrito a ela, ou seja, a integridade da cápsula é preservada. Também são incluídos na categoria de timoma encapsulado (timoma não invasivo) os casos com invasão parcial da cápsula (o tecido tumoral é observado em meio ao tecido conectivo capsular, sem ultrapassar a cápsula totalmente).
• Estádio I: a neoplasia ultrapassa totalmente a cápsula fibrosa (a integridade capsular não está preservada) e penetra o tecido adiposo peritímico sem, contudo, envolver estruturas anatômicas vizinhas, como a pleura, pericárdio ou grandes vasos.
• Estádio IIA: o tumor envolve a veia inonimada, pleura ou parênquima pulmonar. A identificação da veia inonimada é difícil e requer a orientação por parte do cirurgião, de maneira ideal no momento da ressecção. Uma vez identificado o vaso, a neoplasia pode ser encontrada envolvendo a parede do vaso ou invadindo-o. O acometimento pleural é considerado quando há comprometimento da camada fibrosa submesotelial.
• Estádio IIB: a neoplasia envolve o pericárdio. A invasão da camada fibrosa submesotelial também deve ser considerada com acometimento pericárdico.
• Estádio IIC: o tumor pode envolver qualquer um dos grandes vasos por continuidade na parede do vaso ou penetrando-o diretamente. Também é considerado estádio IIC o caso em que há extensão direta ao músculo cardíaco.
• Estádio IIIA: o tumor invade o diafragma não por extensão direta, e sim por implantação por gravidade. A neoplasia deve envolver o músculo esquelético.
• Estádio IIIB: o tumor se estende para qualquer estrutura extratorácica.
As Figuras 1 a 3, a seguir, exemplificam os diferentes estádios tumorais propostos por Moran et al.
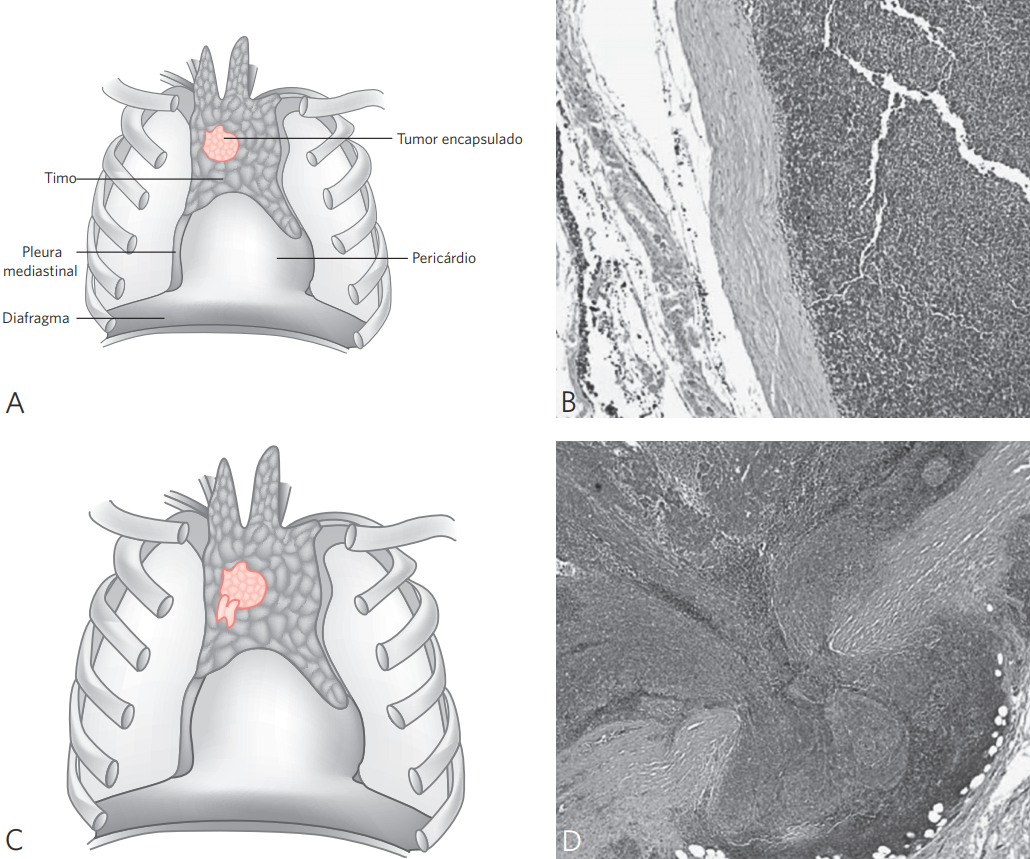
Figura 1 Representação esquemática dos timomas, estádios 0 e I.
Estádio 0: (A) tumor encapsulado; (B) características histológicas de timoma encapsulado – presença de faixa de tecido fibroconectivo denso separando o tumor do tecido adiposo (HE, x10). Estádio I: (C) invasão do tecido adiposo peritímico; (D) características histológicas de timoma invasivo – o tumor invade a cápsula (HE, x10).
Fonte: adaptada de American Society of Clinical Pathology.
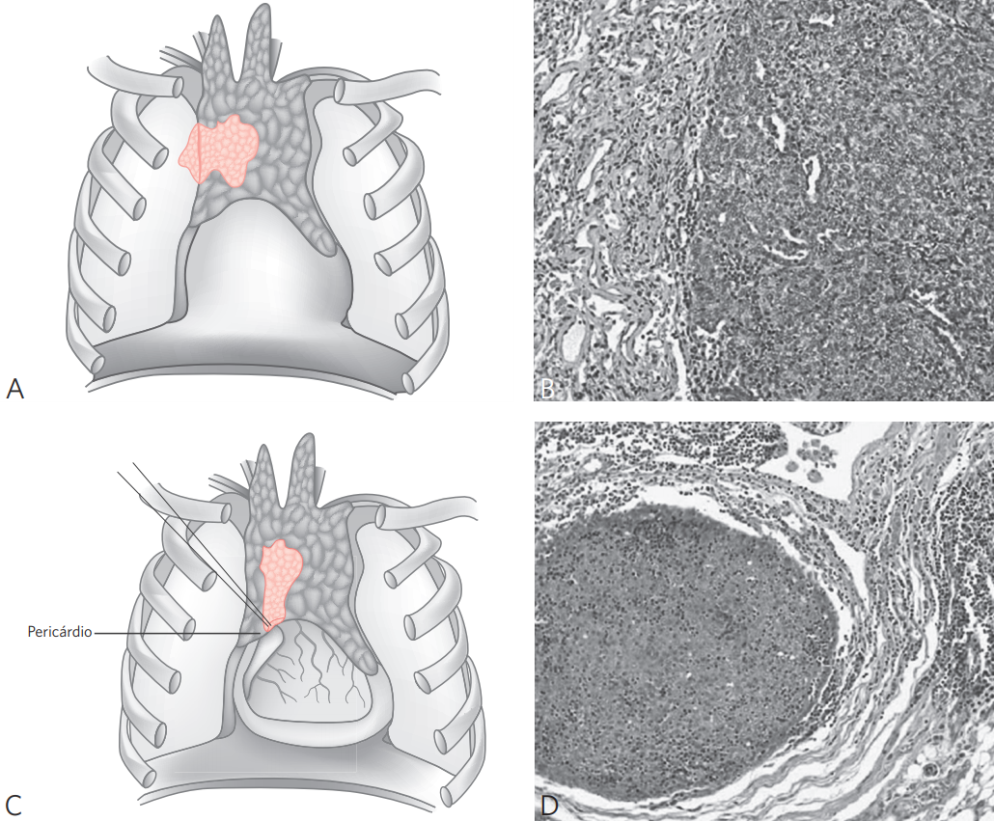
Figura 2 Representação esquemática dos timomas, estádios IIA e IIB.
Estádio IIA: (A) invasão por continuidade da pleura mediastinal, pulmão e/ou veia inonimada; (B) invasão do parênquima pulmonar (HE, x20). Estádio IIB: (C) invasão do pericárdio; (D) exemplo de invasão do pericárdio (HE, x20).
Fonte: adaptada de American Society of Clinical Pathology.
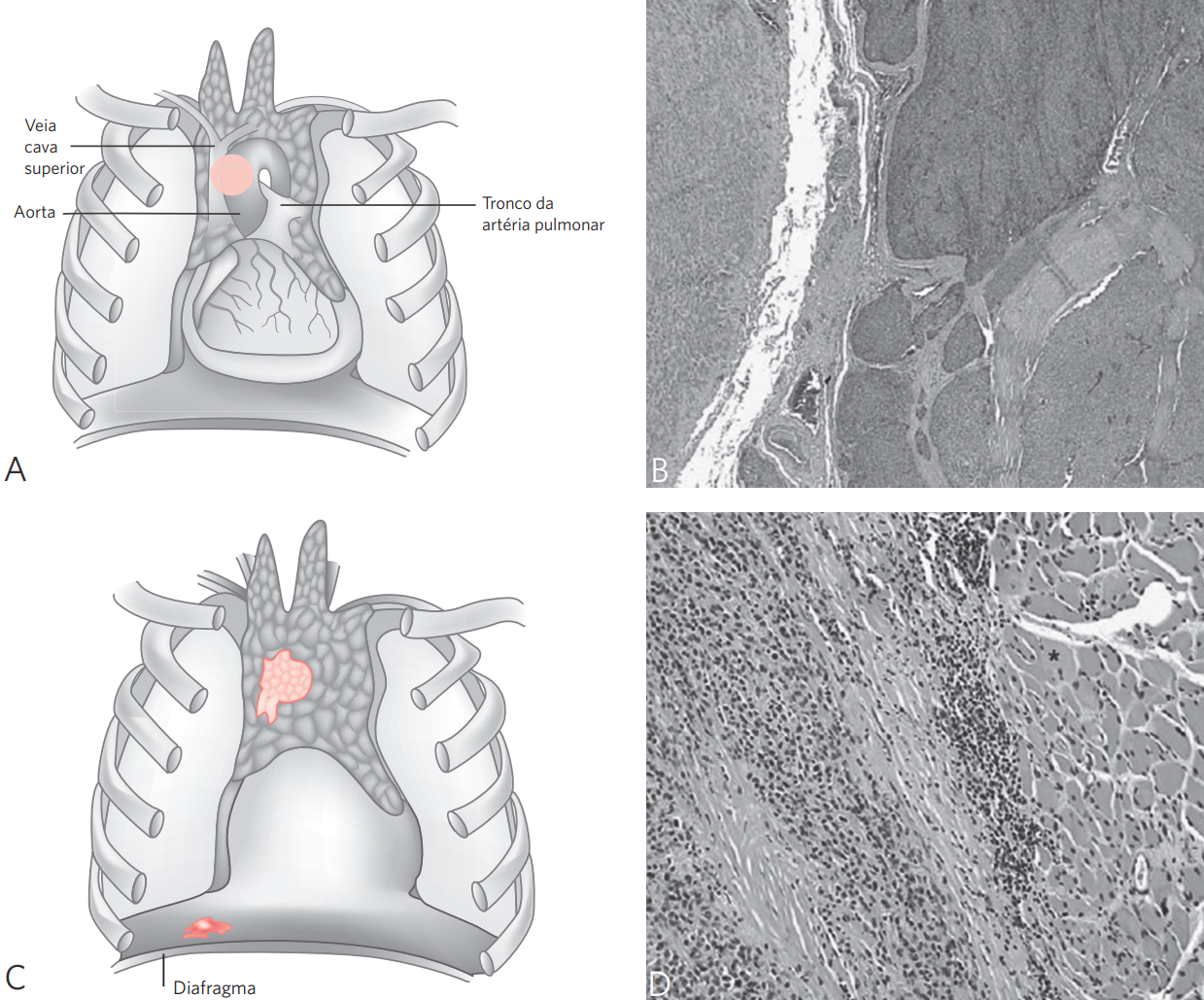
Figura 3 Representação esquemática dos timomas, estádios IIC e IIIA.
Estádio IIC: (A) invasão dos grandes vasos e coração; (B) timoma invadindo veia cava superior (HE, x10). Estádio IIIA: (C) implante tumoral no diafragma; (D) timoma envolvendo o diafragma (HE, x10).
Fonte: adaptada de American Society of Clinical Pathology.
VII.3 Estadiamento patológico (pTNM, AJCC 8a edição)
- __m (tumor primário múltiplo
- __r (recorrente)
- __y (pós-tratamento)
pT – Tumor primário
- pTx – Não avaliável
- pT0 – Não há evidência de tumor primário
- pT1 – Tumor completamente encapsulado ou com extensão na gordura mediastinal; pode envolver a pleura mediastinal
- pT1a – Tumor sem invasão de pleura mediastinal
- pT1b – Tumor com invasão direta da pleura mediastinal
- pT2 – Tumor invade o pericárdio (parcialmente ou toda a espessura)
- pT3 – Tumor com invasão de qualquer uma das seguintes estruturas: pulmão, veia braquicefálica, veia cava superior, nervo frênico, parede torácica ou artérias ou veias pulmonares extrapericárdicas
- pT4 – Tumor com invasão de qualquer uma das seguintes estruturas: aorta (arco, descendente ou ascendente), vasos arqueados, artéria pulmonar intrapericárdica, miocárdio, traqueia, esôfago
pN – Linfonodos regionais
- pNx – Não avaliáveis
- pN0 – Ausência de metástase em linfonodos regionais
- pN1 – Metástase em linfonodos anteriores (peritímicos)
- pN2 – Metástase em linfonodos intratorácicos profundos ou cervicais
pM – Metástases a distância
- pM1 – Metástase pleural, pericárdica ou metástase distante
- pM1a – Nódulo(s) pleural ou pericárdio
- pM1b – Nódulo parenquimatoso pulmonar ou metástase em órgãos distantes
VIII. Considerações gerais
VIII.1 Neoplasias epiteliais do timo, embora raras, são os tumores primários mais comuns do mediastino anterior. Apresentam espectro diversificado, que inclui neoplasias de baixo grau (timoma), de grau intermediário (timoma tipo B3) e de comportamento biológico agressivo (carcinoma tímico). Embora o mediastino anterossuperior corresponda à localização mais frequente deste grupo de tumores, neoplasias epiteliais tímicas têm sido descritas em outras localizações, como mediastino posterior, e em regiões anatômicas extramediastinais, como pleura, região cervical, tireoide e pulmão.
VIII.2 O timoma é definido pela Organização Mundial da Saúde (OMS) como neoplasia originária de/ou exibindo diferenciação epitelial tímica. Apresenta características organotípicas de diferenciação tímica, isto é, lobulação, espaços perivasculares, dupla população celular (epitelial e linfoide), com número variável de linfócitos T imaturos, áreas de diferenciação medular, em menor ou maior grau, e ausência de características citológicas de malignidade.
A classificação proposta pela OMS para os timomas (Tabela 1) é recomendada pelo Colégio Americano de Patologistas (CAP). Todavia, sabe-se que a classificação dos timomas é complexa e que existem dificuldades de reprodutibilidade para o uso dessa classificação entre os patologistas. Dessa forma, outros esquemas de classificação podem ser usados.
VIII.3 O carcinoma tímico é definido pela OMS como neoplasia epitelial maligna com atipias citológicas, invasão e ausência de características organotípicas de diferenciação tímica. Os carcinomas tímicos, de uma forma geral, apresentam comportamento biológico agressivo, são mais frequentemente observados em adultos entre 30 e 60 anos de idade e, geralmente, no momento do diagnóstico, encontram-se em estádio avançado. Os carcinomas tímicos, em geral, não estão associados à miastenia gravis ou outras doenças autoimunes. Em razão da complexa origem embrionária do timo e da ausência de características de diferenciação tímica, os carcinomas tímicos são bastante heterogêneos morfologicamente. Há vários subtipos histológicos de carcinoma tímico que apresentam superposição morfológica com carcinomas de outras localizações anatômicas, incluindo: carcinoma escamoso, carcinoma basaloide, carcinoma mucoepidermoide, carcinoma indiferenciado tipo linfoepitelioma, carcinoma sarcomatoide, carcinossarcoma, adenocarcinoma, carcinoma anaplásico, carcinoma rabdoide, carcinoma neuroendócrino, entre outros. O diagnóstico de carcinoma tímico só pode ser confirmado quando não houver evidência de outra neoplasia, do mesmo tipo histológico, em outra localização anatômica. Em relação aos tumores neuroendócrinos do timo, os mesmos critérios usados na classificação de neoplasia neuroendócrina do pulmão são aplicados na distinção entre carcinoides típico e atípico. A justificativa para incluir o carcinoide típico do timo no grupo de carcinoma neuroendócrino bem diferenciado se deve ao fato de que mesmo tumores aparentemente inocentes, pequenos e encapsulados apresentam capacidade de recorrência e metástase a distância.
VIII.4 Estudo imuno-histoquímico: o componente neoplásico dos timomas, ou seja, as células epiteliais, expressam invariavelmente citoceratina. Os anticorpos anticitoceratina de amplo espectro (p. ex., coquetel de anticorpos monoclonais AE1/AE3) são ideais na caracterização das células neoplásicas do timoma. Caracteristicamente, os timomas expressam citoceratina em padrão “dendrítico” ou “anastomosante”, com exceção do timoma medular em que a positividade é do tipo citoplasmático. Praticamente todos os subtipos de timomas são positivos para citoceratinas 5/6, 7, 14 e 19 e negativos para citoceratina 20. Independentemente do subtipo histológico, todos os timomas são positivos, em padrão nuclear, para proteína P63. Outro achado imuno-histoquímico característico dos timomas é a positividade para CD20, em padrão de membrana, que ocorre em 70 a 90% dos casos especialmente nos subtipos A e AB. O CD5 é negativo nos timomas. Há certa peculiaridade no imunofenótipo da população linfoide dos timomas. Em praticamente todos os timomas, os linfócitos de fundo apresentam imunofenótipo de imaturidade linfoide, ou seja, CD1a+, TdT+ e CD99+. É importante salientar, contudo, que timomas com diferenciação medular costumam exibir maturidade da população linfoide, ou seja, CD1a-, TdT- e CD99-. Em casos de suspeita de timoma ectópico (p. ex., timomas pulmonares ou pleurais), a caracterização de população linfoide imatura é de grande valia na confirmação diagnóstica do timoma, pois essa é a única neoplasia que apresenta população de linfócitos T imaturos de permeio às células neoplásicas epiteliais. Timomas metaplásicos, que são definidos pela presença de ilhas anastomosantes de células epiteliais, em meio às células fusiformes sem atipias, apresentam linfócitos T com imunofenótipo maduro.
Os carcinomas tímicos, por sua vez, expressam CD5 (62 a 80%) e CD117 (80 a 86%). CD5 e CD117 são quase sempre negativos em timomas e não são frequentemente expressos em carcinomas de outros sítios anatômicos. Outro papel da imuno-histoquímica nesse grupo de neoplasia diz respeito à tentativa de definição do subtipo de carcinoma tímico. Por exemplo, em casos de carcinoma tímico com diferenciação neuroendócrina, os marcadores cromogranina A e sinaptofisina devem ser incluídos no painel. Por outro lado, carcinomas tímicos com diferenciação escamosa são positivos para citoceratinas de alto peso molecular, além da proteína P63.
A expressão de PAX8 também tem sido relatada em até 97% dos timomas e em 77% dos casos de carcinomas tímicos.
O diagnóstico de carcinoma do tipo NUT pode ser confirmado através de estudo imuno-histoquímico, FISH ou estudos moleculares.
Tabela 1 Classificação dos timomas (OMS, 2004).
| Tipo de linfoma | Descrição | Frequência |
| A | Timoma medular/de células fusiformes | 4 a 19% |
| AB | Misto | 15 a 43% |
| B1 | Rico em linfócitos/predominantemente cortical | 6 a 17% |
| B2 | Cortical | 18 a 42% |
| B3 | Atípico | 7 a 25% |
IX. Bibliografia
American Society of Clinical Pathology (ASCP). Disponível em: www.ascp.org.
Moran CA, Walsh G, Suster S, Kaiser L. Thymomas II: a clinicopathologic correlation of 250 cases with a proposed staging system with emphasis on pathologic assessment. Am J Clin Pathol 2012; 137(3):451-61.
Moran CA, Weissferdt A, Kalhor N, Solis LM, Behrens C, Wistuba II et al. Thymomas I: a clinicopathologic correlation of 250 cases with emphasis on the World Health Organization schema. Am J Clin Pathol 2012; 137(3):444-50.
Ordóñez NG. Value of PAX 8 immunostaining in tumor diagnosis: a review and update. Adv Anat Pathol 2012; 19(3):140-51.
Rosai J. Appendix D – Standardized surgical pathology reporting for major tumor types.
In: Rosai J (ed.). Ackerman’s surgical pathology. Mosby, 2011.
Suster S. Thimic carcinoma: update of current diagnostic criteria and histologic types. Semin Diagn Pathol 2005; 22(3):198-21.
Travis WD, Brambilla E, Burke AP et al. (eds.). World Health Organization classification of tumors of the lung, pleura, thymus and heart. 4th edition. Lyon: IARC Press, 2015.
Voltar para a página inicial do manual