Daniel Cury Ogata
Códigos de topografia
C16 Estômago
C16.1 Fundo do estômago
C16.2 Corpo do estômago
C16.3 Antro
C16.4 Piloro
C16.5 Pequena curvatura, SOE
C16.6 Grande curvatura, SOE
C16.8 Estômago com lesão invasiva
C16.9 Estômago, SOE
I. Identificação e resumo clínico
II.Dados clínicos relevantes
II.1 História familiar de câncer gástrico
- Ausente
- Presente
Parentesco ________
Idade ao diagnóstico __________ - Ignorado
II.2 Cirurgia gástrica prévia
- Não realizada
- Diagnóstico
Data ___/___ /___
II.3 Biópsia endoscópica prévia
- Não realizada
- Diagnóstico
Data ___/___ /___
II.4 História de doença gástrica prévia
- Ausente
- Presente
- Gastrite atrófica
- Tipo autoimune
- Tipo ambiental
- Tipo não definido
- Metaplasia intestinal
- Úlcera gástrica
- Anastomose (especificar) __________
- Outra (especificar) __________
II.5 Pesquisa de Helicobacter pylori
- Não realizada
- Resultado
Metodologia aplicada (especificar) __________
II.6 Tratamento prévio
- Não
- Sim (especificar) __________
II.7 Estudos moleculares (biomarcadores)
II.7.1 Pesquisa imuno-histoquímico ou por hibridização in situ do HER2
- Realizado
- Não realizado
II.7.2 Pesquisa de instabilidade de microssatélites
- Realizado
- Não realizado
II.7.3 Pesquisa imuno-histoquímica (clone 22C3) do PD-L1
- Realizado
- Não realizado
III. Procedimento cirúrgico
- Biópsia endoscópica ou a céu aberto
- Mucosectomia
- Gastrectomia parcial proximal
- Gastrectomia parcial distal
- Gastrectomia total
- Outro (especificar) __________
IV.Exame macroscópico
IV.1 Tamanho do espécime ___ x ___ x ___ cm
- Grande curvatura ___ cm
- Pequena curvatura ___ cm
- Outros segmentos (especificar) ____________
IV.2 Lesão
- Não identificável macroscopicamente
- Única
- Múltipla
Medidas ___ x ___ x ___ cm
Distância da margem de ressecção mais próxima _________
Localização
Fundo
- Parede anterior
- Parede posterior
Corpo
- Parede anterior
- Parede posterior
- Pequena curvatura
- Grande curvatura
Antro
- Parede anterior
- Parede posterior
- Pequena curvatura
- Grande curvatura
- Outra (especificar) _________
- Não especificada
IV.3 Tipo macroscópico
IV.3.1 Precoce
- Tipo I (protuso)
- Tipo II (superficial)
- IIa – Elevado
- IIb – Plano
- IIc – Deprimido
- Tipo III (ulcerado)
- Tipos mistos ou combinados
IV.3.2 Avançado (Borrmann) (Figura 1 e Tabela 1)
- I – Vegetante/polipóide
- II – Ulcerado
- III – Úlcero-infiltrativo
- IV – Infiltrativo tipo linite plástica
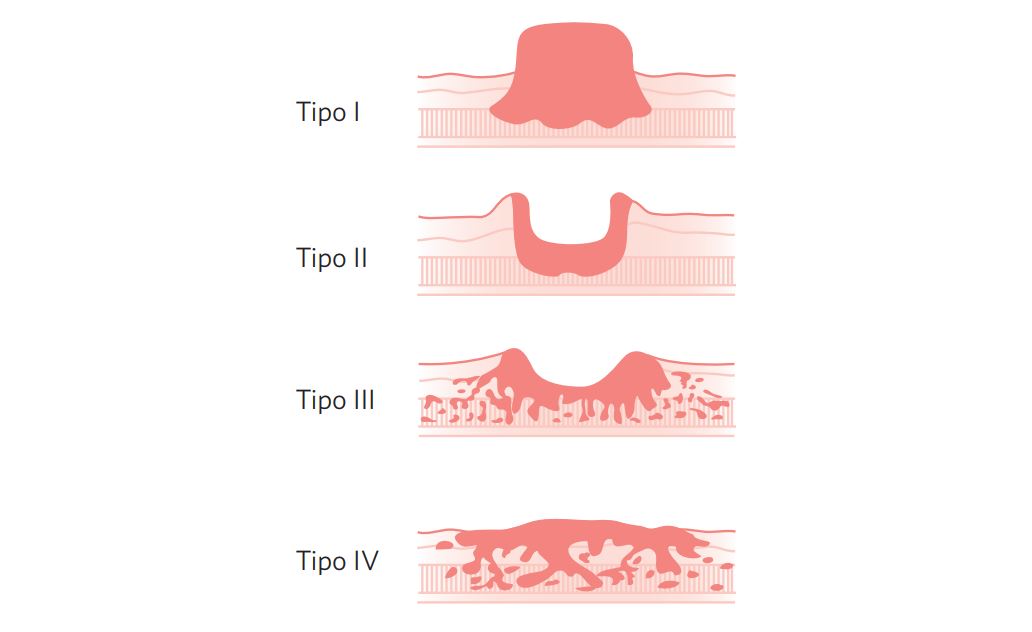
Figura 1 Tipos macroscópicos da neoplasia avançada.
Tabela 1 Descrição dos tipos macroscópicos do carcinoma gástrico precoce.
| Tipos | Desenho esquemático | Descrição |
| I | Protuso | |
| IIa | Superficialmente elevado | |
| IIb | Superficialmente plano | |
| IIc | Superficialmente deprimido | |
| III |  |
Ulcerado |
| Mistos | (IIc + III, III + IIc, etc.) |
IV.4 Mucosa não neoplásica
- Preservada
- Alterada (especificar) __________
IV.5 Linfonodos
- Não identificados
- Presentes
- Grande curvatura (grande curvatura, grande omento, gastroduodenal, gastroepiploicos, pilóricos e duodenopancreáticos)
- Pancreáticos e esplênicos (pancreatocolienal, peripancreáticos e esplênicos)
- Pequena curvatura (pequena curvatura, pequeno omento, gástrica esquerda, cardioesofágicos, hepáticos, celíacos e hepatoduodenais)
- Outros (retropancreáticos, mesentéricos, para-aórticos) __________
IV.6 Processamento macroscópico
Além dos procedimentos de rotina, recomenda-se:
- Localizar a lesão ao exame macroscópico e abrir longitudinalmente pela grande curvatura sem transfixar a lesão; pintar com corante as margens distal e proximal.
• Fazer cortes que incluam o tumor em toda a sua profundidade; incluir fragmentos representativos das margens radial, proximal e distal.
• Assegurar-se de incluir fragmentos da transição entre a lesão e a mucosa não neoplásica.
• Representar fragmentos da mucosa não neoplásica. Se possível, representar corpo e antro, incluindo pequena e grande curvatura.
V. Exame microscópico
V.1 Tipo histológico
- Adenocarcinoma
- Classificação de Laurén
- Tipo intestinal
- Tipo difuso (inclui carcinoma pouco coeso, classificado como >50% das células com morfologia de anel de sinete)
- Tipo misto (proporções semelhantes dos componentes intestinal e difuso)
- Classificação alternativa opcional (baseado na classificação da OMS*)
- Papilar
- Tubular (intestinal)
- Mucinoso (>50% formado por componente mucinoso)
- Carcinoma pouco coeso (incluindo carcinomas difusos, com células em anel de sinete e outras variantes)
- Misto (mistura discreta de componentes glandulares [tubular/papilar] com células em anel de sinete ou pouco coesas)
- Carcinoma adenoescamoso
- Carcinoma com estroma linfoide (carcinoma medular)
- Adenocarcinoma hepatoide
- Carcinoma escamoso
- Carcinoma indiferenciado
- Carcinoma neuroendócrino de pequenas células
- Carcinoma neuroendócrino de grandes células
- Carcinoma neuroendócrino pouco diferenciado#
- Carcinoma adenoneuroendócrino misto
- Outro tipo neuroendócrino não listado (especificar): ______________________
*Organização Mundial da Saúde
# Nota: selecionar essa opção apenas quando os componentes de pequenas ou grandes células não podem ser determinados.
V.2 Grau histológico
- G1 (bem diferenciado)
- G2 (moderadamente diferenciado)
- G3 (pouco diferenciado)
- GX (não pode ser determinado)
- Não aplicável
V.3 Extensão microscópica da neoplasia
- Ausência de tumor primário residual
- Displasia de alto grau/carcinoma in situ
- O tumor invade a lâmina própria
- O tumor invade a muscular da mucosa
- O tumor invade a submucosa
- O tumor invade a camada muscular própria
- O tumor invade o tecido conectivo subseroso sem envolvimento do peritônio visceral ou estruturas adjacentes
- O tumor penetra a serosa (peritônio visceral)
- O tumor invade diretamente órgãos ou estruturas adjacentes (especificar)#
# Estruturas adjacentes do estômago incluem: baço, cólon transverso, fígado, diafragma, pâncreas, parede abdominal, glândula adrenal, rim, intestino delgado e retroperitônio. Extensão intramural para esôfago ou duodeno não é considerada como invasão para estruturas adjacentes. Nestes casos, a classificação continuará baseada na maior profundidade de invasão.
V.4 Invasão vascular
- Não detectada
- Detectada
- Sanguínea
- Linfática
V.5 Invasão perineural
- Não detectada
- Detectada
V.6 Margens cirúrgicas#
- Todas as margens encontram-se livres de carcinoma invasivo, carcinoma in situ ou displasia de baixo grau
- Distância da menor margem em relação ao componente invasivo: ___ cm (especificar)
- Comprometida por carcinoma invasivo (especificar)
- Comprometida por carcinoma in situ (especificar)
- Comprometida por displasia de baixo grau (especificar)
# As margens avaliadas podem ser: proximal, distal, omental (radial), mucosa, profunda e outras. Se todas as margens forem identificadas, elas devem ser reportadas individualmente no laudo anatomopatológico.
V.7 Efeitos de tratamento (carcinomas tratados com terapia neoadjuvante)
- Sem tratamento prévio
- Presentes
- Ausência de células tumorais residuais viáveis (resposta completa, escore 0)
- Células neoplásicas isoladas ou raros pequenos grupos de células neoplásicas (resposta quase completa, escore 1)
- Extensa neoplasia residual, sem evidências de regressão tumoral (resposta pobre ou sem resposta, escore 3)
- Não pode ser determinado
V.8 Linfonodos
- Sem tratamento prévio
- Presentes
- Ausência de células tumorais residuais viáveis (resposta completa, escore 0)
- Células neoplásicas isoladas ou raros pequenos grupos de células neoplásicas (resposta quase completa, escore 1)
- Extensa neoplasia residual, sem evidências de regressão tumoral (resposta pobre ou sem resposta, escore 3)
V.9 Mucosa adjacente
- Metaplasia intestinal (especificar)*
- Sistema de classificação de gastrites OLGA+: Estádio ____
- Sistema de classificação de gastrites OLGIM+: Estádio ____
- Displasia de baixo grau (especificar)#
- Displasia de alto grau (especificar)#
- Gastrite associada ao Helicobacter pylori
- Outro tipo de gastrite (especificar) ___________
- Pólipos (especificar número, tamanho e tipo) __________
- Outros achados (especificar) ____________
* Deve-se determinar o tipo de metaplasia intestinal (completa vs. Incompleta) e extensão, focal, multifocal e difusa.
+ Utilizar as classificações OLGA e OLGIM quando houver representação adequada do corpo e antro.
# Especificar se a displasia é do tipo intestinal (adenomatosa) ou do tipo gástrica
- Estudos moleculares (biomarcadores)
VI.1 Pesquisa imuno-histoquímica para HER2
- Não realizada
- Negativa (escore 0)
- Negativa (escore 1+)
- Duvidosa (escore 2+)
- Positiva (escore 3+)
VI.2 Pesquisa de hibridização in situ para HER2
- Não realizada
- Não amplificada
- Amplificada (ERBB2)
- Quantidade de células contadas: ____________
- Média de sinais de HER2 por célula ____________
- Média de sinais do CEP17 por célula ____________
- Razão do HER2/CEP17 ____________
VI.3 Pesquisa imuno-histoquímica de instabilidade de microssatélites
- Não realizada
- Não foram encontradas perdas nucleares nas expressões das proteínas relacionadas com os genes de reparo do DNA
- Perda nas expressões nucleares das proteínas MLH1 e PMS2
- Perda na expressão nuclear da proteína PMS2
- Perda nas expressões nucleares das proteínas MSH2 e MSH6
- Perda na expressão nuclear da proteína MSH6
VI.4 Pesquisa imuno-histoquímica (clone 22C3) da expressão do PD-L1
- Expressor de PD-L1 (CPS> ou =1)
- Sem expressão de PD-L1 (CPS<1)
VII. Diagnóstico final (exemplo)
Produto de gastrectomia total com linfadenectomia:
- Adenocarcinoma gástrico avançado, medindo 5,5 x 3,5 cm, localizado na incisura angular
- Padrão macroscópico (Borrmann): tipo III (úlcero-infiltrante)
- Classificação de Láuren: Tipo intestinal
- Classificação opcional alternativa (baseado na OMS): Tipo intestinal
- Grau histológico: G2 (moderadamente diferenciado)
- Efeito de tratamento prévio: sem tratamento prévio
- Extensão microscópica da neoplasia: o tumor invade a camada muscular própria
- Invasão vascular: detectada (linfática)
- Infiltração perineural: não detectada
- Mucosa adjacente: Gastrite crônica atrófica, pylori negativo (Sistema de graduação para gastrite OLGA: Estádio IV; Sistema de graduação para gastrite OLGIM: Estádio IV)
- Margem omental (radial): livre
- Margem distal: livre
- Margem proximal: livre
- Distância do carcinoma invasivo à menor margem: 0,8 cm (omental)
- Linfonodos da pequena curvatura: livres de metástases (00/12)
- Linfonodos da grande curvatura: livres de metástases (00/18)
- Estadiamento patológico (pTNM, AJCC* 8a Edition): pT2 pN0 pMx
*American Joint Comitee on Cancer
VIII. Comentários
VIII.1 Classificação TNM dos carcinomas gástricos#
T – Tumor primário
- pTx – Não disponível
- pT0 – Sem evidência de tumor primário
- pTis – Carcinoma in situ (incluindo displasia de alto grau): neoplasia intraepitelial sem invasão da lâmina própria
- pT1 – O tumor invade a lâmina própria, a muscular da mucosa ou submucosa
- pT1a – O tumor invade a lâmina própria ou muscular da mucosa
- pT1b – O tumor invade a submucosa
- pT2 – O tumor invade a camada muscular própria
- pT3 – O tumor penetra o tecido conectivo subseroso, sem invasão do peritônio visceral ou estruturas adjacentes
- pT4 – O tumor invade a serosa (peritônio visceral) ou estruturas adjacentes
- pT4a – O tumor invade a serosa (peritônio visceral)
- pT4b – O tumor invade estruturas adjacentes
N – Linfonodos regionais
- pNx – Não disponíveis
- pN0 – Metástase linfonodal não identificada
- pN1 – Metástases em 1 ou 2 linfonodos perigástricos
- pN2 – Metástases em 3 a 6 linfonodos (peritônio visceral)
- pN3 – Metástases em mais de 6 linfonodos
- pN3a – Metástases em 7 a 15 linfonodos regionais
- pN3b – Metástases em mais de 15 linfonodos regionais
M – Metástase a distância
- M0 – Não identificada
- M1 – Presente##
#Nota: Para identificação de casos especiais, são utilizados os prefixos y, r e a e o sufixo m. O prefixo y afeta o estadiamento patológico, segundo a 8a edição do AJCC. O sufixo m deve ser reservado para os casos de tumores múltiplos no mesmo sítio, identificado entre parênteses (p. ex.: pT(m)NM. O prefixo y indica os casos que vão ser estadiados durante ou depois de terapias multimodais. O prefixo r é utilizado para neoplasias recorrentes e o prefixo a, quando a neoplasia é um achado de autópsia.
##Nota: Depósitos tumorais descontínuos, sem evidência de linfonodo residual e localizado no tecido subseroso adjacente ao carcinoma gástrico são considerados metástases em linfonodos regionais. Implantes nodulares na superfície peritoneal são considerados metástases a distância (M1). Acometimento de linfonodos intra-abdominais, como os retropancreáticos, mesentéricos e para-aórticos, são classificados como metástases a distância (M1).
VIII.2 Grupos prognósticos
Tabela 2 Grupos prognósticos do câncer gástrico
| Grupo | T | N | M |
| 0 | Tis | N0 | M0 |
| IA | T1 | N0 | M0 |
| IB | T2 | N0 | M0 |
| IIA | T3 | N0 | M0 |
| T2 | N1 | M0 | |
| T1 | N2 | M0 | |
| IIB | T4a | N0 | M0 |
| T3 | N1 | M0 | |
| T2 | N2 | M0 | |
| IIIA | T4a | N0 | M0 |
| T4b | N0 | M0 | |
| T3 | N2 | M0 | |
| T2 | N3a | M0 | |
| IIIB | T4b | N1 ou N2 | M0 |
| T4a | N3a | M0 | |
| T3 | N3a | M0 | |
| T1 ou T2 | N3b | M0 | |
| IIIC | T4b | N3a ou N3b | M0 |
| T4a | N3b | M0 | |
| T3 | N3b | M0 | |
| IV | Qualquer T | Qualquer N | M1 |
Tabela 3 Grupos prognósticos do câncer gástrico pós-neoadjuvância (ypTNM)
| Grupo | T | N | M |
| I | T1 ou T2 | N0 | M0 |
| T1 | N1 | M0 | |
| II | T1 | N2 ou N3 | M0 |
| T2 | N1 ou N2 | M0 | |
| T3 | N0 ou N1 | M0 | |
| T4a | N0 | M0 | |
| III | T2 | N3 | M0 |
| T3 | N2 ou N3 | M0 | |
| T4a | N1 à N3 | M0 | |
| T4b | Qualquer N | M0 | |
| IV | Qualquer T | Qualquer N | M1 |
IX.Considerações gerais
IX.1 Tumores da junção gastroesofágica (JGE)
A origem dos tumores da JGE (gástrica versus esofágica) é um assunto extremamente controverso na literatura, mas dados recentes favorecem a origem esofágica. Com base nesses achados e com o objetivo principal de melhor estadiamento da doença, o Colégio Americano de Patologistas (CAP) recomenda que estes tumores sejam estadiados de acordo com as diretrizes aplicadas aos tumores do esôfago.
IX.2 Tipos histológicos
A classificação de tumores do trato gastrointestinal revisada e publicada em 2010 pela Organização Mundial de Saúde (OMS) (Tabela 3) inclui um novo subgrupo de tumores classificados como carcinomas de células pouco coesas, que incorpora o tipo difuso e de células em anel de sinete.
Tabela 3 Classificação histológica da OMS para os carcinomas do estômago.
| Tipo tumoral | Achados histológicos |
| Adenocarcinoma | |
| Papilar | Exofítico, com extensões frondosas alongadas, contendo eixos fibrovasculares; geralmente são de baixo grau |
| Tubular | Túbulos ramificados tipo fendas ou dilatados; geralmente de baixo grau, embora a variante pouco diferenciada possa ser descrita |
| Carcinoma de células pouco coesas | Células tumorais infiltram como células isoladas únicas ou em pequenos agregados. Carcinomas com células em anel de sinete, são formados predominantemente por células contendo mucina citoplasmática que desloca o núcleo. Existem variantes de carcinoma pouco coesivo, que podem mimetizar infiltrado inflamatório mononuclear reacional ou linfoma |
| Mucinoso | Contém mais de 50% de mucina extracelular. Pode conter células em anel de sinete isoladas |
| Misto | Mistura de componentes morfológicos identificáveis, tais como: papilar, tubular e pouco coesivo |
| Carcinoma adenoescamoso | Mistura de componentes neoplásicos glandulares e escamosos; este ultimo deve compreender pelo menos 25% do volume tumoral |
| Carcinoma com estroma linfóide (carcinoma medular) | Estruturas glandulares pouco desenvolvidas, associada à proeminente infiltrado linfoide no estroma. Associado com infecção pelo vírus do Epstein-Barr, podendo ter um prognóstico mais favorável |
| Adenocarcinoma hepatóide | Células tumorais eosinofílicas e poligonais, lembrando hepatócitos; pode expressar alfa-fetoproteína |
| Carcinoma escamoso | Formas queratinizantes e não queratinizantes são encontradas |
| Carcinoma indiferenciado | Carcinoma de alto grau que não pode ser classificado como adenocarcinoma, carcinoma escamoso, ou outras variantes |
| Carcinoma neuroendócrino | Carcinoma de alto grau, com expressão difusa para sinaptofisina e focal para a cromogranina A. Esses tumors exibem alto índice mitótico (>20 por 10 campos de grande aumento, ou ki-67>20%), marcante atipia nuclear e podem ter focos de necrose. |
| Neuroendócrino de grandes células | Células tumorais são grandes, com moderada quantidade de citoplasma, e pode conter proeminente nucléolo |
| Neuroendócrino de pequenas células | Células tumorais são pequenas, com cromatina finamente granular e nucléolo indistinto |
| Adenoneuroendócrino misto | Composto por uma mistura de componentes formando glândulas e elementos neuroendócrinos malignos, com pelo menos 30% de cada componente. Identificação de células neuroendócrinas isoladas em adenocarcinomas por imuno-histoquímica, não qualifica como carcinoma misto |
IX.3 Grau histológico
Para os adenocarcinomas, o sistema de graduação histológica é baseado na extensão da diferenciação glandular:
Grau 1 (bem diferenciados):
- As estruturas glandulares bem formadas representam mais de 95% do tumor.
Grau 2 (moderadamente diferenciados):
- As estruturas glandulares bem formadas representam entre 50 e 95% do tumor.
Grau 3 (pouco diferenciados):
- As estruturas glandulares bem formadas representam menos de 49% do tumor.
Os carcinomas de células em anel de sinete ou de células isoladas são tumores de alto grau e devem ser classificados como grau 3.
Na 8a edição do American Joint Cancer Comitee (AJCC), os carcinomas indiferenciados foram agrupados juntamente com os carcinomas pouco diferenciados, como grau 3. Carcinomas neuroendócrinos de pequenas células, que eram classificados como grau 4, agora são considerados grau 3.
IX.4 Efeitos de tratamento
A resposta patológica tumoral à terapia neoadjuvante tem sido apontada como um dos principais fatores prognósticos. Seguindo as recomendações do CAP, um esquema com boa reprodutibilidade interobservador classifica de acordo com a quantidade de células tumorais residuais (Tabela 4).
Tabela 4 Graduação patológica de regressão tumoral.*
| Achados histológicos | Graduação da resposta patológica |
| Ausência de células viáveis | 0 (resposta completa) |
| Células tumorais isoladas ou em pequenos agrupamentos | 1 (resposta moderada) |
| Blocos tumorais residuais em meio a áreas de fibrose | 2 (resposta mínima) |
| Extenso componente tumoral residual | 3 (pouca resposta ou sem resposta) |
* Nota: Como existem diversos sistemas para graduação da regressão tumoral, recomenda-se que também seja semiquantificado, da melhor forma possível, o percentual da lesão composto por células neoplásicas, por fibrose/proliferação vascular/inflamação e por necrose.
IX.5 Marcadores biomoleculares
IX.5.1 HER2
Dados de estudos clínicos de fase III (ToGA, protocolo BO18255) demonstraram que pacientes com carcinomas gástricos HER2 superexpressos/amplificados que fizeram uso deste esquema terapêutico apresentaram redução do tamanho tumoral, diminuição das metástases abdominais e maior tempo de sobrevida global e livre de doença.
O sucesso do uso desta terapêutica depende principalmente de uma seleção criteriosa de pacientes que realmente terão algum benefício, evitando assim gastos desnecessários e efeitos colaterais indesejáveis.
A pesquisa da expressão e/ou amplificação de HER2 nos carcinomas gástricos deve ser determinada pela pesquisa da expressão proteica por imuno-histoquímica. A interpretação deve ser feita criteriosamente utilizando as recomendações específicas para os carcinomas gástricos, que mostram diferentes critérios em relação aos amplamente utilizados para os escores da mama e com diferenças de interpretação dependendo do tipo de material analisado (biópsia endoscópica versus peça cirúrgica).
Os casos com escore 2, classificados como duvidosos, devem ser obrigatoriamente submetidos a um exame de hibridização in situ.
Os testes de imuno-histoquímica ou hibridização in situ para o HER2 podem ser realizados em material proveniente de biópsias endoscópicas ou peças cirúrgicas, mas por causa da grande heterogeneidade tumoral, característica dos carcinomas gástricos, devem estar atentos ao número de fragmentos representativos do tumor presentes nas biópsias endoscópicas. O número mínimo recomendado é de seis fragmentos. Recomenda-se também retestar a pesquisa de HER2 nas peças cirúrgicas, nos casos com resultados negativos pesquisados nas biópsias endoscópicas.
Os testes de hibridização in situ (fluorescente ou em campo claro) devem ser feitos, preferencialmente, em laboratórios centrais com experiência e grande volume de testes de hibridização. Os critérios de interpretação recomendados são semelhantes aos já utilizados nos carcinomas mamários. Recomenda-se a contagem de no mínimo 20 núcleos tumorais analisando-se o número total de sinais representativos das cópias do gene HER2 e do centrômero do cromossomo 17 de cada célula. A amplificação é definida nos casos em que a razão do HER2 pelo cromossomo 17 for maior ou igual a 2. Nos casos cuja razão estiver entre 1,8 e 2,2, recomenda-se a contagem de mais 20 núcleos. Nos casos de polissomia (número de sinais representativos do cromossomo superior a 4), devem-se considerar amplificados os casos em que o número de cópias do gene for maior do que 6 (Tabela 5).
Tabela 5 Critérios de interpretação dos achados imuno-histoquímicos do HER2 nos carcinomas gástricos.
| Escore | Padrão de marcação da peça cirúrgica | Padrão de marcação da biópsia endoscópica | Resultado |
| 0 | Sem reatividade ou reatividade membranosa em < 10% das células tumorais | Sem reatividade ou sem reatividade membranosa | Negativo |
| 1+ | Reatividade membranosa fraca ou pouco perceptível em ≥ 10% das células tumorais; células reativas apenas em parte da membrana | Reatividade membranosa de grupos de células tumorais (mínimo de 5 células) com marcação fraca ou pouco perceptível | Negativo |
| 2+ | Reatividade membranosa completa, basolateral ou lateral em ≥ 10% das células tumorais com marcação fraca a moderada | Reatividade membranosa completa, basolateral ou lateral de grupos de células tumorais (mínimo de 5 células) com marcação fraca a moderada | Indeterminado |
| 3+ | Reatividade membranosa forte completa, basolateral ou lateral em ≥ 10% das células tumorais | Reatividade membranosa completa, basolateral ou lateral com marcação forte, independente do percentual de células neoplásicas positivas | Positivo |
IX.5.2 PD-L1
O PD-L1 (Programmed Death Ligand-1) é um checkpoint inibitório do sistema imune. Normalmente, esta proteína é expressa nas células inflamatórias (linfócitos e macrófagos) e nas células neoplásicas. A sua ligação com a molécula PD-1 (Programmed Death-1) pode resultar na inativação da resposta imunológica, resultando numa imunossupressão no nicho tumoral, favorecendo o avanço da neoplasia. Recentemente, estudos mostraram que o bloqueio do PD-L1 ou do PD-1 são eficazes para o tratamento de certas neoplasias, incluindo alguns tipos de câncer de pulmão, bexiga, colo uterino, cabeça e pescoço e estômago. A análise da expressão do PD-L1 nos casos de câncer gástrico ou da junção esôfago-gástrica é realizada por meio da avaliação combinada de imunomarcação para este anticorpo. O anticorpo escolhido e aprovado pelo Food and Drug Administration (FDA) foi o clone 22C3 pharmDx (Dako). Esta análise combinada, referida na literatura como Combinated Proportional Score (CPS) é calculada pelo número de células neoplásicas somado aos linfócitos e macrófagos relacionados ao tumor, todas elas expressando o PD-L1 com padrão de membrana citoplasmática total ou parcial, independente da intensidade, dividido pelo número de células tumorais viáveis e este resultado multiplicado por 100. Recentemente um estudo chamado KEYNOTE 059 mostrou que na terceira linha de tratamento, o pembrolizumabe para pacientes com câncer gástrico e da junção esôfago-gástrica, com CPS>1, podem apresentar maior duração de resposta e menor toxicidade, comparado à quimioterapia.

IX.Bibliografia
Amin MB, Edge SB, Greene FL, et al, eds. AJCC Cancer Staging Manual. 8th New York, NY: Springer; 2017.
Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A et al.; ToGA Trial Investigators. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376(9742):687-97.
Bartley, AN, Washington, MK, Ventura, CB et al. HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma: Guideline From the College of American Pathologists, American Society for Clinical Pathology, and American Society of Clinical Oncology. Arch Pathol Lab Med. 2016 Dec; 140(12):1345-1363.
Bosman FT, Carneiro F, Ralph H, Hruban, Teise N (eds.). World Health Organization Classification of tumours of the digestive system. 4. ed. Geneva: WHO, 2010.
Edge SB, Byrd DR, Carducci MA, Compton CC (eds.). AJCC cancer staging manual. 7. ed. New York: Springer, 2010.
Fuchs CS, Doi T, Jang RW, Muro K, Satoh T, Machado M et al. Safety and Efficacy of Pembrolizumab Monotherapy in Patients with previously trated advanced gastric and gastroesophageal junction cancer. Phase 2 Clinical KEYNOTE-059 Trial. JAMA Oncol 2018; 4(5):e180013.doi:10.1001/jamaoncol.2018.0013
Hofmann M, Stoss O, Shi D, Büttner R, van de Vijver M, Kim W et al. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopathology 2008; 52(7):797-805.
Kulangara K, Zang N, Corigliano E, Guerrero L, Waldroup S, Jaiswal D et al. Clinical Utility of the Combined Positive Score for Programmed Death Ligand-1 Expression and the Approval of Pembrolizumab for Treatment of Gastric Cancer. Arch Pathol Lab Med 2018; doi: 10.5858/arpa.2018-0043- OA
Lauren P. The two histológica main types of gastric carcinoma. Acta Pathol Microbiol Scand 1965; 64:31-49.
Rüschoff J, Hanna W, Bilous M, Hofmann M, Osamura RY, Penault-Llorca F et al. HER2 testing in gastric cancer: a practical approach. Mod Pathol 2012; 25:637-50.
Ryan R, Gibbons D, Hyland JMP, Treanor D, White A, Mulcahy HE et al. Pathological response following long-course neoadjuvant chemoradiotherapy for locally advanced rectal cancer. Histopathology. 2005;47:141-6.
Voltar para a página inicial do manual
