Maria Aparecida Marchesan Rodrigues e Luciana Rodrigues de Meirelles
Códigos de topografia
C18.9 Cólon, SOE
C19.0 Junção retossigmoide
C20.0 Ampola retal
Biópsia excisional (polipectomia)
I. Identificação e resumo clínico
II. Procedimento cirúrgico
- Biópsia endoscópica
- Polipectomia por laçada
- Polipectomia por fórceps
- Outro (especificar) ___________
III. Exame de congelação
- Não realizado
- Realizado
- Do tumor
- Negativo
- Positivo
- Inconclusivo
- Da margem
- De outro tecido (especificar) ___________
- Negativo
- Positivo
- Inconclusivo
- Do tumor
IV .Exame macroscópico (Ver comentário 1)
Localização da lesão
- Ceco
- Cólon ascendente
- Flexura hepática
- Cólon transverso
- Flexura esplênica
- Cólon descendente
- Sigmóide
- Reto
- Não especificado
Tamanho da lesão ___ x ___ x ___ cm.
Configuração da lesão
- Pólipo com pedículo
- Comprimento do pedículo: ___ cm
- Pólipo sem pedículo
- Lesão séssil
- Lesão fragmentada
V. Exame microscópico
Tipo histológico (OMS, 2010)
- Adenoma:
- tubular (80% estrutura tubular)
- viloso (80% estrutura vilosa)
- túbulo-viloso (20 a 80% estrutura vilosa)
- Lesão serrilhada:
- Pólipo hiperplásico
- Adenoma/pólipo séssil serrilhado
- Adenoma serrilhado tradicional
- Hamartoma:
- Pólipo juvenil
- Pólipo de Peutz-Jeghers
- Pólipo associado a Síndrome de Cowden
- Outro
Neoplasia intraepitelial (displasia) (Ver comentário 2)
- Não se aplica
- Baixo grau (displasia leve e moderada)
- Alto grau (displasia intensa)
Margem de ressecção cirúrgica
- Comprometida por neoplasia intraepitelial de baixo grau
- Comprometida por neoplasia intraepitelial de alto grau
- Livre
- Não avaliável
Carcinoma em adenoma
- Ausente
- Presente (tamanho da lesão: ___ x ___ mm)
Tipo histológico (OMS, 2010)
- Adenocarcinoma
- Carcinoma mucinoso/colóide (>50% da área tumoral)
- Carcinoma de células em anel de sinete (>50% da área tumoral)
- Carcinoma neuroendócrino de alto grau
- Carcinoma neuroendócrino de grandes células
- Carcinoma neuroendócrino de pequenas células
- Carcinoma de células escamosas
- Carcinoma adenoescamoso
- Carcinoma medular
- Carcinoma indiferenciado
- Outro (especificar):
Grau de diferenciação
- Baixo grau (bem e moderadamente diferenciado)
- Alto grau (pouco diferenciado ou indiferenciado)
- Não aplicável
- Não pode ser determinado
Profundidade de invasão tumoral
- Não pode ser determinada
- Restrito à mucosa: _ carcinoma in situ _invasão da lâmina própria
- Invasão do pedículo de lesão polipóide (profundidade: ___ mm)
- Invasão da muscular da mucosa
- Invasão da submucosa (profundidade a partir da muscular da mucosa: mm)
- Invasão da muscular própria (se amostrada)
Margens cirúrgicas (lateral da ressecção / profunda / base do pedículo)
- Comprometida (s) pelo componente invasivo. Especificar a margem____
- Livres de neoplasia invasiva, distando a mais próxima ___ cm do componente invasivo
- Presença de componente in situ / neoplasia intraepitelial de alto grau na margem. Especificar a margem _______________
- Presença de neoplasia intraepitelial de baixo grau na margem. Especificar a margem ______________________
- Não avaliáveis
Invasão linfovascular
- Não detectada
- Em vasos linfáticos
- Em vasos sanguíneos
Alterações patológicas adicionais
- Não identificadas
- Retocolite ulcerativa idiopática
- Em atividade
- Quiescente
- Outra (especificar) _________
Estudos auxiliares
- Especificar _________________
- Não realizado
Diagnóstico final (exemplo)
Produto de polipectomia:
Adenocarcinoma bem diferenciado com invasão da lâmina própria da mucosa, medindo 0,5 x 0,3 cm originando-se em adenoma túbulo-viloso séssil (3,0 x 2,0 cm) em topografia de reto. Invasão angiolinfática e perineural não detectadas.
Margens de ressecção cirúrgica laterais e profunda livres de neoplasia invasiva, porém, comprometidas por neoplasia intraepitelial de baixo grau.
Comentários
- Processamento macroscópico
1.1. Polipectomia (pólipo com pedículo)
Identificar no exame macroscópico o pedículo ou o local de ressecção. A área do pedículo deve ser previamente marcada pelo endoscopista com corante, fio ou outro marcador. Medir o comprimento do pedículo. Fazer um corte paralelo à margem distal do pedículo (A). Fazer cortes longitudinais sucessivos do pólipo (B) de modo que o ápice e a base da lesão possam ser examinados à histologia (Figura 1). Toda a lesão deve ser submetida a exame histológico.
Figura 1
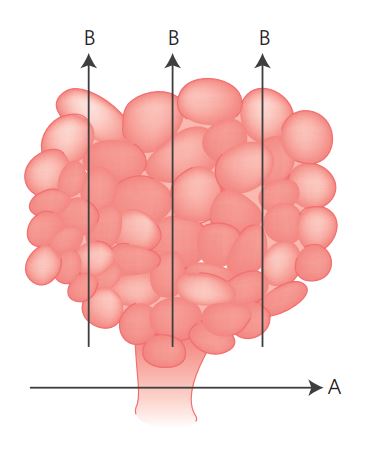
Figura 1 Polipectomia.
- Exérese de lesão séssil ou de lesão maior que 3,0 cm
A lesão deve ser fixada estendida sobre superfície (papel de filtro ou outro suporte). Identificar com corante a área de ressecção cirúrgica. Fazer cortes longitudinais sucessivos da lesão (A) de modo que o ápice e a base da lesão possam ser examinados em nível histológico (Figura 2). Submeter cortes semi-sucessivos da lesão a exame histológico. Áreas de depressão, ulceração ou de consistência firme identificadas no exame macroscópico devem ser examinadas a nível histológico.
Figura 2
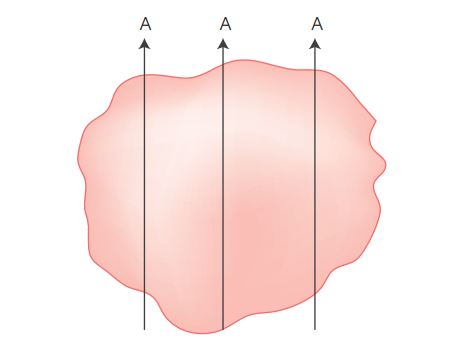
Figura 2 Exérese de lesão séssil ou maior que 3 cm.
1.3 Biópsia endoscópica (por pinça)
Todos os fragmentos devem ser submetidos a exame histológico. Fazer cortes seriados de toda a lesão.
2. Grau da neoplasia intraepitelial/displasia nos adenomas
| Grau | Alterações
Estruturais |
Alterações dos
Núcleos |
Diferenciação
Citoplasma |
Mitoses |
|
Baixo |
Túbulos regulares
justapostos ramificados |
Discariose leve
a moderada Núcleos alongados Polaridade mantida |
Redução da
produção de muco leve a moderada |
Pouco
frequentes |
|
Alto |
Túbulos irregulares
Justapostos Ramificações complexas |
Discariose intensa
Núcleos ovais Nucléolos proeminentes Perda da polaridade dos núcleos |
Basofilia
Perda da produção de muco |
Frequentes |
- Carcinoma em Adenoma
A identificação de adenocarcinoma invasivo originando-se em adenoma, em peças de polipectomia, requer a avaliação de fatores histológicos preditivos de evolução adversa, tais como recorrência local da lesão ou metástases em nódulos linfáticos. Os critérios histológicos que favorecem risco de evolução desfavorável compreendem:
-Tipo histológico da lesão maligna: carcinoma de alto grau
-Proximidade da lesão maligna da margem cirúrgica: menor que 1mm.
– Identificação de invasão angiolinfática
Ressecção cirúrgica do cólon e reto
I. Identificação e resumo clínico_______________________
II. Dados clínicos relevantes __________________________
III. Exame por congelação
- Não.
- Local (tumor, margem, de outro tecido) e resultado (positivo, negativo, inconclusivo)
Espécime
- Ileo terminal
- Ceco
- Apêndice cecal
- Cólon ascendente
- Cólon transverso
- Cólon descendente
- Sigmóide
- Reto
- Outro (especificar) _____________
- Não especificado
IV. Procedimento Cirúrgico
- Hemicolectomia direita
- Hemicolectomia esquerda
- Colectomia transversa
- Sigmoidectomia
- Colectomia total (com ou sem apêndice cecal)
- Ressecção abdominoperineal de reto
- Outro (especificar) _____________
- Não especificado
V. Exame Macroscópico (Ver comentário 1)
Peça cirúrgica:
comprimento ___cm; perímetro proximal:____cm; distal:___cm; médio:___cm.
Lesão:
- Não identificável macroscopicamente
- Única
- Múltiplas (identificar margens, outras lesões e incluir separadamente)
Localização da lesão
- Ceco
- Cólon ascendente
- Flexura hepática
- Cólon transverso
- Flexura esplênica
- Cólon descendente
- Sigmóide
- Retossigmóide
- Reto
- Não especificada
Pólipo preexistente no local da lesão
- Sem evidência de pólipo preexistente
- Pólipo preexistente do tipo ____________________
Tamanho da lesão (medidas ___x ___ x ___cm)
Configuração da lesão
- Plana
- Exofítica (polipoide, séssil)
- Ifiltrativa (anular-constrictiva)
- Ulcerativa (ulcero-infiltrativa)
- Outra (especificar) _____________________
Perfuração macroscópica da lesão
- Presente
- Ausente
Integridade macroscópica do mesorreto
- Não aplicável
- Completa
- Incompleta
- Não pode ser determinada
Classificação histológica (OMS, 2010) (Coment 2)
- Adenocarcinoma
- Carcinoma mucinoso/colóide (>50% da área tumoral)
- Carcinoma de células em anel de sinete (>50% da área tumoral)
- Carcinoma neuroendócrino de alto grau (pequenas ou grandes células)
- Carcinoma escamoso
- Carcinoma adenoescamoso
- Carcinoma medular
- Carcinoma indiferenciado
- Outro (especificar):
Grau histológico
- Baixo grau (bem e moderadamente diferenciado)
- Alto grau (pouco diferenciado ou indiferenciado)
- Não aplicável
- Não pode ser determinado
Profundidade de invasão
- Não pode ser determinada
- Sem evidência de tumor primário
- Ausência de invasão da lâmina própria
- Carcinoma intramucoso. Invasão da lâmina própria/ muscular da mucosa
- Invasão da submucosa
- Invasão da muscular própria
- Invasão da subserosa/ tecidos moles pericólicos/perirretais
- Invasão/perfuração do peritônio visceral ou invasão direta de órgãos/estruturas adjacentes
VI. Margens cirúrgicas
Margem proximal
- Não pode ser determinada
- Livre de comprometimento neoplásico
- Comprometida por neoplasia
- Comprometida por neoplasia “in situ”
Margem distal
- Não pode ser determinada
- Livre de comprometimento neoplásico
- Comprometida por neoplasia
- Livre de neoplasia “in situ”
- Comprometida por neoplasia “in situ”
Margem radial (profunda) ou margem mesentérica (Comentário 1)
- Não pode ser determinada
- Livre de comprometimento neoplásico (distância mais próxima da neoplasia:______ cm)
- Comprometida por neoplasia
Outra Margem (especificar)
- Livre de comprometimento neoplásico
- Comprometida por neoplasia
Invasão linfática/vascular
- Presente
- Não detectada
Invasão perineural
- Presente
- Não detectado
Infiltrado de linfócitos intratumoral/peritumoral (Coment 3)
- Ausente
- Discreto a moderado
- Intenso (pode haver formação de agregados linfóides)
Efeitos de tratamento (para terapia neoadjuvante do câncer de reto)
(Comentário 4)
- Sem tratamento prévio
- Presente
- Ausência de neoplasia residual (resposta completa, grau 0)
- Resposta moderada (neoplasia residual, grau 1)
- Resposta mínima (grau 2)
- Ausente (grau 3)
Depósitos tumorais no tecido adiposo (Coment 5)
- Não identificados
- Presente (especificar quantidade_____)
Estadiamento patológico (pTNM) (Coment 6 e 7)
Tumor primário (pT)
- pTx Tumor primário não avaliado
- pT0 Sem evidência de tumor
- pTis Carcinoma in situ ou intramucoso
- p T1 Tumor invade submucosa
- pT2 Tumor invade muscular própria
- pT3 Tumor invade serosa ou tecido pericólico/perirretal
- pT4a Tumor perfura peritônio visceral
- pT4b Tumor invade diretamente outros órgãos ou estruturas adjacentes
Linfonodos regionais (pN)
- pNx Linfonodos regionais não avaliados
- pN0 Ausência de metástases para linfonos regionais
- pN1a Metástase em 1 linfonodo regional
- pN1 b Metástases em 2 a 3 linfonodos regionais
- pN1c Implantes tumorais na gordura pericólica, sem evidência de metástases em nódulos linfáticos
- pN2a Metástases em 4 a 6 linfonodos regionais
- pN2b Metástases em 7 ou mais linfonodos regionais
Especificar: número de linfonodos examinados ___
número de linfonodos comprometidos ___
Metástases à distância (pM)
- pM1a Metástase para um órgão à distância, sem evidência de metástase peritonial. Especificar___
- pM1b Metástase para dois ou mais órgãos à distância, sem evidência de metástase peritonial. Especificar___
- pM1c Metástase para o peritônio, com ou sem evidências de metástases para órgãos à distância
Alterações patológicas adicionais
- Intestino não neoplásico sem anormalidades
- Adenoma(s)
- Retocolite ulcerativa idiopática: _com displasia _sem displasia
- Doença de Crohn
- Divertículos: _com diverticulite _ sem diverticulite
- Colite actínica
- Outros pólipos (especificar) ___________________
Estudos adicionais
- Análise imuno-histoquímica. Especificar ___________
- Análise molecular. Especificar ______________
Diagnóstico final (exemplo):
Produto de ressecção abdomino-perineal de reto:
Adenocarcinoma moderadamente diferenciado em topografia de reto (a 1,0 cm da linha pectínea). Lesão úlcero-infiltrativa residual (pós-quimioterapia e radioterapia neoadjuvantes), medindo 8,3×4,8×2,3cm. Infiltração do mesorreto, distando 1,0 cm da margem radial (ypT3).
Sinais de involução tumoral parcial presentes com áreas de necrose tumoral e calcificação.
Invasão neoplásica de vasos linfáticos e perineural. Não identificada invasão de vasos sanguíneos.
Metástases para vinte e um (21) de trinta e sete (37) linfonodos dissecados em mesocólon e para um (01) de dois (02) linfonodos dissecados em fáscia pré-sacral enviados em separado (ypN2b).
Margens de ressecção cirúrgica proximal e distal livres de neoplasia.
Margem radial livre, distando cerca de 1,0 cm da neoplasia.
Colite crônica ulcerativa com alterações morfológicas compatíveis com etiologia actínica.
Estadiamento patológico: ypT2 ypN2b cM0, estádio IIIB.
VII. Comentários
- Processamento macroscópico
Localizar a lesão ao exame externo e abrir a alça intestinal longitudinalmente pela borda mesentérica, sem transfixar a lesão (Figura 3). Marcar com corante a área mais profunda de invasão tumoral (margem radial) e as margens cirúrgicas proximal e distal.
A lesão deve ser fixada estendida sobre superfície (isopor ou outro suporte). Fazer cortes longitudinais da transição tumor/mucosa preservada proximal e distal (A). Fazer cortes perpendiculares da lesão para analisar a profundidade de invasão do tumor na parede do colón ou do reto e a margem radial, que corresponde à margem profunda da ressecção cirúrgica (B). Para os tumores do colón, a margem radial é a gordura mesentérica. Para os tumores do reto é a gordura perirretal.
Fazer cortes das margens proximal e distal. Se a distância do tumor for < 2cm, fazer corte longitudinal à margem cirúrgica. Se a distância do tumor for > 2cm, fazer corte paralelo à margem cirúrgica.
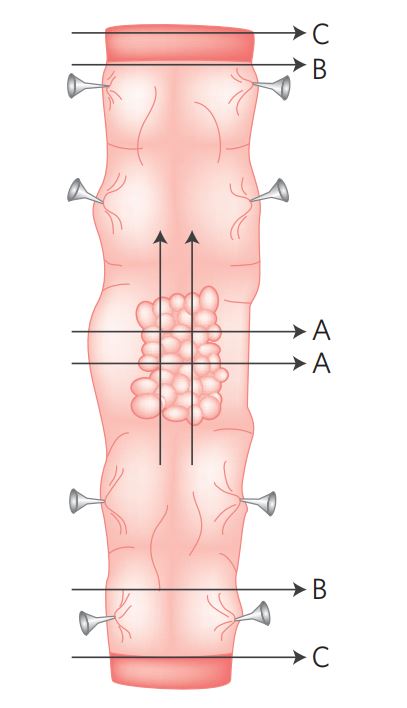
Figura 3 Processamento macroscópico.
- Tipos histológicos
A classificação histológica utilizada neste protocolo é a proposta pela Organização Mundial da Saúde (OMS) em 2010. (ver VII 1)
Quando a neoplasia apresenta lagos de muco com revestimento epitelial parcial e/ou células neoplásicas soltas em mais de 50% da lesão, deve ser classificada como adenocarcinoma mucinoso/colóide. Este tipo de lesão pode apresentar número variável de células em anel de sinete. A classificação do adenocarcinoma mucinoso como lesão de alto grau (pouco diferenciado) com base na formação de glândulas e atipias celulares é questionável. O melhor é classificá-lo como adenocarcinoma mucinoso sem graduação da diferenciação.
Quando há células em anel de sinete em mais de 50% da lesão, a neoplasia deve ser classificada como carcinoma de células em anel de sinete, que é considerada lesão de alto grau (pouco diferenciada).
O carcinoma medular tem prognóstico relativamente melhor que os demais tipos histológicos. Não deve ser classificado como carcinoma pouco diferenciado ou indiferenciado. É um tipo histológico distinto, associado à instabilidade de microssatélites, que indica defeitos nos genes de reparo do DNA. As células neoplásicas dispõem-se em blocos sólidos, arranjos trabeculares ou organóides, sem evidências imunohistoquímicas de diferenciação neuroendócrina. Outra característica é o grande número de linfócitos intratumorais. Pode ocorrer de forma esporádica ou associado à HNPCC.
O carcinoma indiferenciado apresenta menos de 5% de formações glandulares, em geral, com células neoplásicas em cordões, ninhos e/ou trabéculas e extensas áreas de necrose tumoral associadas.
- Análise molecular
A análise molecular não faz parte do estadiamento patológico do câncer do colón e do reto. Constitui informação complementar com utilidade preditiva de resposta terapêutica e avaliação prognóstica.
Os principais marcadores moleculares analisados no câncer do colón são: altos níveis de expressão de instabilidade de microssatélites (MSI –MSH-H) que se correlacionam com bom prognóstico e mutação no gene BRAF que sinaliza mau prognóstico. Mutações no gene Kras, Nras e BRAF estão relacionadas à resistência ao tratamento com anticorpo monoclonal ao receptor do fator de crescimento epidérmico (EGFR) no câncer de colon avançado.
A investigação molecular de MSI pode ser combinada com análise imunohistoquímica para MSI para rastreamento do câncer de colon hereditário não associado à polipose (HNPCC – Síndrome de Lynch).
4. Critérios sugestivos de instabilidade de microssatélites
Características histopatológicas preditivas de instabilidade de microssatélites incluem a presença de infiltrado linfóide intratumoral (> 2 linfócitos/campo grande aumento), reação linfoide Crohn-like, padrão de crescimento medular, diferenciação mucinosa ou carcinoma de células em anel de sinete e lesão situada no colon direito. A identificação de tumores associados à instabilidade de microssatélites é importante visto que constitui critério de rastreamento para o câncer de colon hereditário não associado à polipose (HNPCC – Síndrome de Lynch). As diretrizes de Bethesda para detecção do HNPCC recomendam o teste de instabilidade de microssatélites em casos de câncer de colon e reto nas seguintes situações:
- Câncer de colon e reto em paciente com idade inferior a 50 anos.
- Presença de tumores sincrônicos, metacrônicos, ou de outras neoplasias associadas à HNPCC (carcinoma de endométrio, estômago, ovário, pâncreas, ureter e pélvis renal, trato biliar, intestino delgado) independentemente da idade.
- Câncer de colon e reto com as características histológicas preditivas de instabilidade de microssatélites acima descritas.
- Câncer de colon e reto em 1 ou mais parentes de primeiro grau de um indivíduo com HNPCC, com 1 dos tumores diagnosticado em indivíduo com idade inferior a 50 anos.
- Câncer de colon e reto diagnosticado em 2 ou mais parentes de primeiro ou segundo grau de indivíduo com HNPCC, independentemente da idade.
Efeitos de tratamento
Regressão tumoral após terapia neoadjuvante no câncer de reto deve ser analisada somente no tumor primário. A área correspondente à neoplasia deve ser incluída totalmente para exame histopatológico. Evidências histológicas de regressão tumoral incluem: necrose, fibrose, calcificação, depósitos de hemossiderina, histiócitos xantomatosos, erosões e úlceras. Pools acelulares de mucina não são considerados como neoplasia residual.
O grau de regressão do tumor deve ser estimado segundo a tabela abaixo.
Tabela 2 Grau de Regressão do Tumor
| Critério | Grau de Regressão do Tumor |
|
Ausência de células neoplásicas viáveis |
0 (Resposta completa) |
| Células neoplásicas isoladas ou em pequenos grupos |
1 ( Resposta moderada) |
|
Neoplasia Residual com fibrose |
2 ( Resposta mínima) |
|
Neoplasia Residual extensa, necrose mínima |
3 (Ausência de Resposta ) |
Fonte: Modificado Ryan et al, 2005
- Depósitos tumorais (extensão extramural descontínua)
Depósitos irregulares de tumor na gordura pericólica e perirretal são considerados como nódulos ou implantes satélites, relacionados à invasão linfovascular. Devem ser relatados na categoria N1c. Quando os nódulos forem arredondados, de bordas regulares, devem ser considerados como metástases em nódulos linfáticos, independentemente de suas dimensões.
Invasão venosa extramural deve ser relatada, pois constitui fator prognóstico independente com maior risco de metástases hepáticas (tributárias da veia porta).
- Estadiamento
Os tumores que devem ser analisados neste sistema de estadiamento compreendem os adenocarcinomas do colon e do reto, o carcinoma neuroendócrino de alto grau e o carcinoma escamoso do colon e do reto. Não fazem parte deste sistema de estadiamento os linfomas, sarcomas, tumores neuroendócrinos de baixo grau, o carcinoma do apêndice cecal e o carcinoma anal.
Os critérios utilizados para o estadiamento das lesões compreendem T (tumor) N (nódulos linfáticos regionais) e M (metástases à distância). Não há fatores prognósticos adicionais.
A definição de metástases à distância foi ampliada pela AJCC (2017) com a inclusão de M1c para caracterizar as metástases para o peritônio como fator de mau prognóstico.
O prefixo p é utilizado para designar o estadiamento anátomopatológico do tumor. O prefixo y deve ser usado para os tumores estadiados após tratamento por quimio ou radioterapia. O prefixo r deve ser usado para designar recidiva do tumor. O prefixo c refere-se ao estadiamento clínico. O prefixo a refere-se ao estadiamento por exame de necropsia. O sufixo “m” refere-se à presença de tumores primários múltiplos (sincrônicos no mesmo órgão e deve ser referido entre parênteses: pT(m)NM
No estadiamento do carcinoma de colon e reto deve haver informação clínica da pesquisa de metástases à distância através do exame físico e/ou de métodos de imagem. O patologista não deve utilizar a designação pM0 pois esta categoria refere-se à ausência global de metástases no organismo.
Informações do exame patológico tais como ausência de linfonodos na peça cirúrgica examinada ou margem radial não analisada, devem ser incluídas no laudo pois são relevantes para o prognóstico e tratamento adequado.
Os marcadores moleculares não fazem parte do estadiamento patológico, visto não haver evidências de que sejam fatores prognósticos. Devem ser incluídos no laudo como informações complementares visando correlações futuras.
7.Grupos prognósticos (AJCC, 8a edição, 2017)
Na Tabela abaixo estão assinaladas em vermelho modificações em relação à edição anterior deste Manual de padronização de laudos histopatológicos.
| T | N | M | Estadio TNM |
|
Tis |
N0 |
M0 |
0 |
|
T1-T2 |
N0 |
M0 |
I |
|
T3 |
N0 |
M0 |
IIA |
|
T4a |
N0 |
M0 |
IIB |
|
T4b |
N0 |
M0 |
IIC |
|
T1–T2 |
N1/N1c |
M0 |
IIIA |
|
T1 |
N2a |
M0 |
IIIA |
|
T3–T4a |
N1/N1c |
M0 |
IIIB |
|
T2–T3 |
N2a |
M0 |
IIIB |
|
T1–T2 |
N2b |
M0 |
IIIB |
|
T4a |
N2a |
M0 |
IIIC |
|
T3–T4a |
N2b |
M0 |
IIIC |
|
T4b |
N1–N2 |
M0 |
IIIC |
|
Qquer T |
Qquer N |
M1a |
IVA |
|
Qquer T |
Qquer N |
M1b |
IVB |
|
Qquer T |
Qquer N |
M1c |
IVC |
VIII. Bibliografia
Bosman FT, Carneiro F, Hruban RH, Theise ND. WHO Classification of Tumours of the Digestive System. 4th ed. Lyon, 2010.
Edge SB, Byrd DR, Compton CC, Fritz AG, Greene FL, Trotti A. AJCC Cancer Staging Handbook, 8th ed. New York: Springer, 2017.
Iacobuzio-Donahue CA, Montgomery EA. Gastrointestinal and Liver Pathology, 2nd Ed. Philadelphia: Elsevier Saunders, 2012.
Odze, DR, Goldblum JR. Surgical Pathology of the GI Tract, Liver, Biliary Tract and Pancreas, 3nd ed. Elsevier, 20014.
Ryan R, Gibbons D, Hyland JM, Treanor D, White A et al. Pathological response following long-course neoadjuvant chemoradiotherapy for locally advanced rectal cancer. Histopathology. 2005 ;47:141-6.
Voltar para a página inicial do manual