Alexandre Rolim da Paz
Códigos de topografia
C65 Neoplasia maligna da pelve renal
C66 Neoplasia maligna dos ureteres
I. Identificação e resumo clínico
II. Dados clínicos relevantes
Nota: Na identificação do paciente, além dos dados relativos a idade, cor, sexo e número de prontuário, deve constar a lateralidade da amostra, bem como um sumário clínico detalhado. História de procedimentos urinários prévios ou tratamentos anteriores, como radioterapia e quimioterapia, devem estar consignados ao resumo clínico. Neoplasias prévias devem ser relatadas minuciosamente, incluindo localização, tipo e grau histológicos, além de afecções não neoplásicas que possam interferir na interpretação histológica das lesões, como nefro/ureterolitíase e infecções urinárias. Alguns grupos populacionais têm maior risco de desenvolver tumores uroteliais do trato urinário superior: trabalhadores expostos a corantes à base de anilina, usuários abusivos de analgésicos e habitantes de certas áreas geográficas, como os Bálcãs, onde há nefropatia endêmica. Os carcinomas uroteliais do trato urinário superior também estão presentes na síndrome do câncer colorretal hereditário não associado à polipose ([HNPCC] síndrome de Lynch II).
III. Procedimento cirúrgico
- Nefroureterectomia radical
- Nefroureterectomia parcial
- Ureterectomia segmentar
- Biópsia
- Outro (especificar) ___________
- Não determinado
IV. Exame macroscópico
IV.1 Integridade da amostra
- Íntegra
- Seccionada
- Fragmentada
IV.2 Fixação da amostra
- Formalina tamponada
- Formalina não tamponada
- Álcool
- A fresco
- Outro (especificar) __________
- Não pode ser determinada
IV.3 Aspecto macroscópico
- Papilífero
- Polipoide
- Nodular
- Ulcerado
- Infiltrativo
- Outro (especificar) _____________
- Não determinado
IV.4 Tamanho da lesão
- ___ x ___ x ___ cm
- Não pode ser determinado
IV.5 Extensão da lesão
- Restrita à pelve renal
- Restrita ao ureter
- Compromete a pelve renal e o ureter
- Compromete o seio/hilo renal
- Infiltra o parênquima renal
- Infiltra o tecido adiposo perirrenal/periureteral
- Invade órgão adjacente
- Não pode ser determinada
IV.6 Procedimento macroscópico
IV.6.1 Biópsias por agulha ou ressecção endoscópica
Toda a amostra deve ser submetida à avaliação histopatológica.
IV.6.2 Nefroureterectomia
Medir e pesar o espécime, identificar o coto ureteral e vasos do hilo renal, e dissecar o tecido adiposo perirrenal à procura de linfonodos. Seccionar longitudinalmente o espécime por meio do hilo renal, identificar a lesão e fixar em formalina tamponada por 12 a 24 horas. Em seguida, retirar amostras para documentar a relação do tumor com a (A) profundidade de invasão no córion/muscular própria, (B) infiltração do parênquima renal adjacente, (C) pelve renal/ureter não tumoral, (D) hilo renal com vasos e tecido adiposo peripélvico/periureteral, (E) margem cirúrgica ureteral e/ou manguito vesical (“Cuff” vesical – margens de mucosa e de partes moles) e (F) margem cirúrgica de partes moles periureteral/perirrenal (Figura 1).
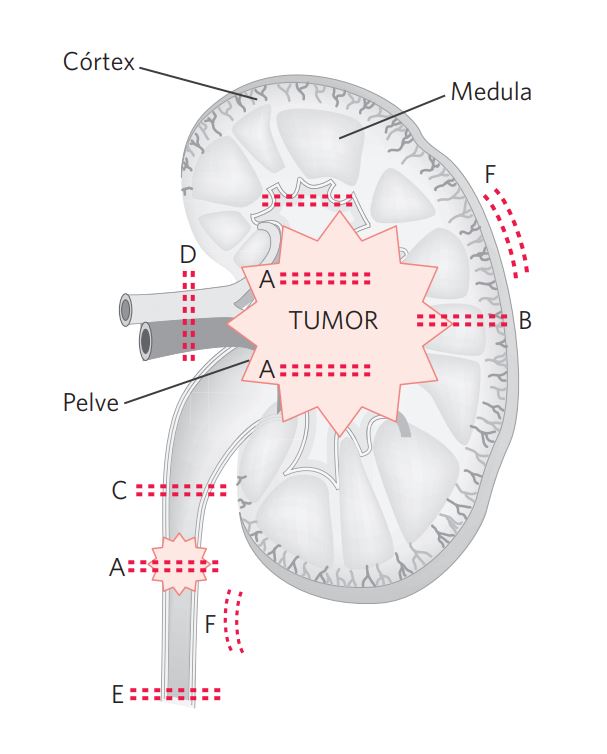
Figura 1 Nefroureterectomia
IV.6.3 Ureterectomia segmentar
Procedimento utilizado para casos selecionados de tumores situados nos terços proximal ou médio do ureter. O comprimento e o diâmetro do segmento ureteral devem ser anotados, e a superfície externa marcada por tinta nanquim. Seccionar longitudinalmente o segmento e registrar as alterações macroscópicas na mucosa. Secções devem ser obtidas de: (A) lesão, para demonstrar a profundidade de invasão; (B) lesão + mucosa adjacente; (C) ao menos uma secção da mucosa aparentemente normal; (D) margem distal; e (E) margem proximal (Figura 2).
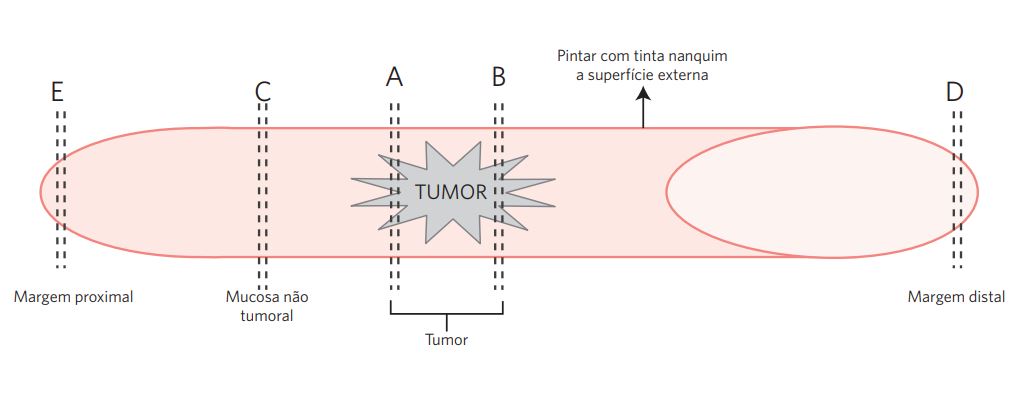
Figura 2 Ureterectomia segmentar.
Nota 1: Anatomia da pelve renal/ureter: o lúmen da pelve renal/ureter está revestido por urotélio (também chamado epitélio de transição), que repousa em uma membrana basal situada sobre lâmina própria constituída por tecido conectivo frouxo altamente vascularizado. Diferentemente do observado na bexiga e no ureter, a lâmina própria está ausente abaixo do urotélio que reveste a papila renal na pelve e ao longo dos cálices menores. O urotélio é constituído por três a cinco camadas de células na pelve e quatro a sete camadas de células no ureter. A pelve e o ureter têm uma
parede contínua muscular que se origina nos fórnices dos cálices menores como pequenos fascículos de células musculares lisas entrelaçadas. A muscular própria não está dividida em camadas distintas, externa e interna. Próximo à bexiga, o ureter adquire uma bainha externa do músculo detrusor e os fascículos musculares se orientam longitudinalmente. As fibras longitudinais continuam através da parede da bexiga e alcançam a submucosa, na qual se espalham sobre o orifício ureteral e contribuem para a formação do trígono vesical. Essas fibras terminam próximo do colo da bexiga na mulher e no verumontanum no homem.
Nota 2: Aspectos macroscópicos dos tumores de pelve renal/ureter: geralmente são lesões papilíferas, friáveis, que devem ser fixadas antes de retirados os fragmentos para microscopia. Tumores papilíferos grandes frequentemente causam oclusão do ureter e consequente hidronefrose. Alguns tumores da pelve renal infiltram o tecido subjacente ou o parênquima renal de forma compressiva, com bordos rombos e sem infiltração evidente à macroscopia, ou exibem aparência macroscópica de massas esquirrosas invadindo o parênquima renal e com pouca evidência de origem na mucosa da pelve renal. Nestes casos, a representação extensa da lesão e do tecido renal adjacente é recomendada, bem como métodos auxiliares como imuno-histoquímica para comprovar a origem na pelve renal.
V. Exame microscópico
V.1 Tipo histológico
- Carcinoma urotelial papilífero, não invasivo
- Carcinoma urotelial papilífero, invasivo
- Carcinoma urotelial “in situ”
- Carcinoma urotelial invasivo
- Carcinoma urotelial, variante em ninhos (“nested type”)
- Carcinoma urotelial, variante microcística
- Carcinoma urotelial, variante micropapilífera
- Carcinoma urotelial, variante sarcomatoide
- Carcinoma urotelial, variante de células claras
- Carcinoma urotelial, variante linfoepitelioma-símile
- Carcinoma urotelial, variante plasmocitoide/difusa/células em “anel-de-sinete”
- Carcinoma urotelial, variante pouco diferenciada
- Carcinoma urotelial, variante de células ricas em lipídeo
- Carcinoma urotelial, variante de células gigantes
- Carcinoma urotelial com diferenciação escamosa ( ___% do componente escamoso)
- Carcinoma urotelial com diferenciação glandular ( ___% do componente glandular)
- Carcinoma urotelial com diferenciação trofoblástica ( ___% do componente trofoblástico)
- Carcinoma urotelial com diferenciação Mülleriana ( ___% do componente Mülleriano)
- Carcinoma de células escamosas
- SOE
- Verrucoso
- Carcinoma de células escamosas “in situ”
- Adenocarcinoma
- SOE
- Tipo entérico
- Tipo mucinoso
- Misto
- Adenocarcinoma “in situ”
- Tumores neuroendócrinos
- Carcinoma de pequenas células
- Carcinoma de grandes células
- Carcinoma neuroendócrino bem diferenciado
- Tumores do tipo Mülleriano
- Carcinoma de células claras
- Carcinoma ednometrioide
- Carcinoma indiferenciado (especificar) ____________
- Carcinoma metastático
- Outros tipos histológicos
V.3 Grau histológico (OMS/ISUP)
- Carcinoma urotelial
- Alto grau
- Baixo grau
- Carcinoma de células escamosas / adenocarcinoma
- Bem diferenciado (G1)
- Moderadamente diferenciado (G2)
- Pouco diferenciado (G3)
- Outro carcinoma (especificar) ____________
- Baixo grau
- Alto grau
- Não aplicável
- Não pode ser determinado
V.4 Extensão neoplásica
- Não pode ser determinada
- Sem evidências de tumor primário
- Carcinoma papilífero não invasivo
- Carcinoma “in situ” (plano)
- O tumor infiltra o tecido conectivo subepitelial (lâmina própria)
- Há representação histológica da camada muscular própria
- Não há representação histológica da camada muscular própria
- A representação da camada muscular própria não pode ser determinada
- Infiltração da camada muscular própria indefinida
- O tumor infiltra a camada muscular própria
- O tumor infiltra além da camada muscular própria
- Infiltra o tecido adiposo peripélvico ou o parênquima renal (neoplasia da pelve renal)
- Infiltra o tecido adiposo periureteral (neoplasia ureteral)
- O tumor infiltra órgãos adjacentes ou através do rim em direção ao tecido adiposo perirrenal
V.5 Invasão neoplásica angiolinfática
- Presente
- Não detectada
- Não pode ser determinada
V.6 Margem(ns) cirúrgica(s)
- Não pode ser determinada
- Comprometida(s) por carcinoma invasivo
- Margem ureteral proximal
- Margem ureteral distal
- Margem radial (periureteral/perirrenal)
- Comprometida(s) por carcinoma “in situ”/carcinoma urotelial de alto grau não invasivo
- Margem ureteral proximal
- Margem ureteral distal
- Margem radial (periureteral/perirrenal)
- Livre(s) de comprometimento por carcinoma invasivo/carcinoma “in situ”/carcinoma urotelial de alto grau não invasivo
V.7 Lesões epiteliais associadas
- Não detectadas
- Displasia urotelial
- Papiloma urotelial
- Papiloma urotelial do tipo invertido
- Neoplasia urotelial papilífera de baixo potencial de malignidade
- Não podem ser determinadas
V.8 Achados anatomopatológicos no tecido renal não neoplásico
- Tecido renal insuficiente
- Alterações morfológicas significativas (especificar) ____________
V.9 Linfonodos regionais
- Número de linfonodos encontrados
- Número de linfonodos comprometidos pela neoplasia
- Tamanho do maior foco metastático
- Tamanho do maior linfonodo comprometido pela neoplasia
- Extensão neoplásica extranodal
- Presente
- Ausente
- Não pode ser determinada
VI. Diagnóstico final (exemplo)
VI.1 Produto de nefroureterectomia direita
Carcinoma urotelial de alto grau da pelve renal. Tamanho: 4,5 cm. Presença de infiltração neoplásica da camada muscular própria da pelve. Ausência de infiltração neoplásica do tecido renal subjacente. Invasão neoplásica angiolinfática: não detectada. Hilo e seio renal livres de comprometimento neoplásico. Presença de extensão neoplásica ao segmento ureteral, sem infiltração do córion subjacente. Margens cirúrgicas ureteral e perirrenal livres de comprometimento neoplásico. Margem cirúrgica radial (circunferencial) livre de comprometimento neoplásico. Linfonodo do tecido adiposo perirrenal sem evidências de comprometimento neoplásico. Estadiamento patológico (TNM): pT2 pN0.
VI.2 Biópsia/ressecção endoscópica
Carcinoma urotelial papilífero de baixo grau. Ausência de infiltração neoplásica do córion. Ausência de representação histológica da camada muscular própria. Estadiamento patológico: pTa.
VII. Comentários
VII.1 Estadiamento patológico (pTNM, AJCC 8a edição) dos tumores da pelve renal/ureter.
pT – Tumor primário
- pTX – Não pode ser determinado
- pT0 – Sem evidência de tumor primário
- pTa – Carcinoma papilífero não invasivo
- pTis – Carcinoma in situ (plano)
- pT1 – O tumor infiltra o tecido conectivo subepitelial (lâmina própria)
- pT2 – O tumor infiltra a camada muscular própria
- pT3 – O tumor infiltra além da camada muscular no tecido adiposo peripélvico ou no parênquima renal (tumor da pelve renal) ou no tecido adiposo periureteral (tumores do ureter)
- pT4 – O tumor infiltra órgãos adjacentes ou através do rim em direção ao tecido adiposo perirrenal (tumores renais)
pN – Linfonodos regionais
- pNX – Não podem ser determinados
- pN0 – Sem metástase linfonodal
- pN1 – Metástase menor ou igual a 2 cm no maior diâmetro em linfonodo regional único
- pN2 – Metástase maior do que 2 cm no maior diâmetro em linfonodo regional único; ou metátastes em múltiplos linfonodos regionais
- Linfonodos ausentes
pM – Metástases a distância
- Não se aplica
- pM1 – Metástase presente
Especificar topografia ____________
VIII. Considerações gerais
VIII.1 Epidemiologia e tipos histológicos do carcinoma da pelve renal/ureter
Os tumores da pelve renal são duas vezes mais comuns do que os ureterais. Os tumores primários da pelve renal representam cerca de 7% de todos os tumores renais. A maioria (mais de 95% dos casos) dos carcinomas da pelve renal e ureter é de origem urotelial. Cerca de 2 a 4% dos casos são bilaterais. A multifocalidade é relativamente frequente, sendo detectada em 21 a 47% dos pacientes com carcinomas uroteliais da pelve renal. Cerca de 50% dos pacientes com tumores do trato urinário podem ter associado um carcinoma urotelial de bexiga. A mucosa adjacente aos tumores invasivos pélvico/ureteral está alterada por displasia ou carcinoma “in situ” em até 90% dos casos.
A localização mais comum dos tumores ureterais é no segmento distal e, por causa da alta recorrência dessas neoplasias no segmento distal ao tumor ressecado (15 a 20%), a nefroureterectomia com ressecção de um manguito (cuff) vesical é considerada a cirurgia de escolha. O carcinoma urotelial é um tumor heterogêneo com grande propensão a subtipos histológicos distintos e diferenciação divergente, com aspectos morfológicos característicos. Essas variantes têm significado clínico em diversos níveis: (1) diagnóstico, na medida em que a identificação correta de determinada variante morfológica for essencial para evitar interpretações errôneas, principalmente com lesões benignas e tumores metastáticos; (2) prognóstico, para estratificação de risco do paciente; (3) terapêutica, em que o diagnóstico de uma variante em particular pode estar associado com a introdução de uma terapia diferente da utilizada para os carcinomas uroteliais convencionais.
Uma variedade de padrões arquiteturais não usuais, como os tipos em ninho, invertido e microcístico, podem ser confundidos com processos reativos ou tumores benignos. Outros, como as variantes plasmocitoide, micropapilar e de células discoesivas, podem simular tumores metastáticos.
Duas regras gerais devem estar sempre presentes ao se avaliar uma variante histológica de carcinoma urotelial: primeiramente, deve-se deixar consignado ao laudo anatomopatológico esse achado, pois as metástases decorrentes podem exibir apenas esse fenótipo não usual, o que facilita a correlação com o tumor primário; segundo, quanto mais o tumor se afasta do aspecto urotelial usual, mais se aproxima de uma neoplasia metastática ou infiltrando secundariamente a bexiga. Em geral, os carcinomas uroteliais com aspectos morfológicos não usuais têm pior prognóstico
do que os carcinomas uroteliais convencionais. A variante plasmocitoide tem com frequência expressão imuno-histoquímica positiva para CD138, o que dificulta ainda mais o diagnóstico diferencial com plasmocitoma.
VIII.2 Classificação e graduação histológica das neoplasias uroteliais
Em razão do frequente padrão papilífero e friável das neoplasias, que as tornam muito propensas à fragmentação e ao deslocamento de blocos tumorais, recomenda-se adequada fixação do material antes do processamento macroscópico. Isso permite melhor acurácia na classificação e no estadiamento dos tumores. A graduação histológica é semelhante à utilizada para os tumores vesicais. Utiliza-se a classificação 2016 da Organização Mundial de Saúde (OMS):
Tumores Uroteliais
Carcinoma urotelial invasivo
Tipo em ninhos
Microcístico
Micropapilífero
Linfoepitelioma-símile
Plasmacitoide/”anel-de-sinete”/difuso
Sarcomatoide
Células gigantes
Pouco diferenciado
Lesões uroteliais não invasivas
Carcinoma urotelial “in situ”
Carcinoma urotelial papilífero não-invasivo, baixo grau
Carcinoma urotelial papilífero não-invasivo, alto grau
Neoplasia urotelial papilífera de potencial maligno incerto
Papiloma urotelial
Papiloma urotelial invertido
Proliferação urotelial de potencial maligno incerto
Displasia urotelial
Neoplasias de células escamosas
Carcinoma de células escamosas (puro)
Carcinoma verrucoso
Papiloma de células escamosas
Neoplasias glandulares
Adenocarcinoma, SOE
Entérico
Mucinoso
Misto
Adenoma viloso
Tumores do tipo Mülleriano
Carcinoma de células claras
Carcinoma endometrioide
Tumores Neuroendócrinos
Carcinoma de pequenas células
Carcinoma de grandes células
Tumor neuroendocrine bem diferenciado
Paraganglioma
VIII.3 Estadiamento
O fator prognóstico mais importante para o carcinoma da pelve renal/ureter é o estadiamento e a profundidade da invasão neoplásica. Outros fatores incluem grau histológico, margens cirúrgicas, invasão angiolinfática, idade e tipo de tratamento, bem como a presença e a gravidade da neoplasia urotelial associada.
IX. Bibliografia
Amin MB, Edge SB, Greene FL, et al, eds. AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer; 2017
Catto JW, Yates DR, Rehman I, Azzouzi AR, Patterson J, Sibony M et al. Behavior of urothelial carcinoma with respect to anatomical location. J Urol 2007; 177:1715-20.
Chang A, Amin A, Gabrielson E, Illei P, Roden RB, Sharma R et al. Utility of Gata3 immunohistochemistry in differentiating urothelial carcinoma from prostate adenocarcinoma and squamous cell carcinomas of the uterine cervix, anus and lung. Am J Surg Pathol 2012; 36:1472-6.
Delahunt B, Amin MB, Hofstader F et al. Tumours of the renal pelvis and ureter. In: Eble JN, Sauter G, Epstein JI, Sesterhenn IA (eds.). World Health Organization classification of tumours: pathology and genetics of tumours of the urinary system and male genital organs. Lyon: IARC; 2004.
Edge SB, Byrd DR, Carducci MA, Compton CC (eds.). AJCC cancer staging manual. 7. ed. New York: Springer, 2009.
Epstein JI, Amin MB, Reuter VR, Mostofi FK; The Bladder Consensus Conference Committee. The World Health Organization/International Society of Urological Pathology Consensus classification of urothelial (transitional cell) neoplasms of the urinary bladder. Am J Surg Pathol 1998; 22:1435-48.
Gupta R, Paner GP, Amin MB. Neoplasms of the upper urinary tract: a review with focus on urothelial carcinoma of the pelvicalyceal system and aspects related to its diagnosis and reporting. Adv Anat Pathol 2008; 15:127-39.
Margulis V, Shariat SF, Matin SF, Kamat AM, Zigeuner R, Kikuchi E et al.; The Upper Tract Urothelial Carcinoma Collaboration. Outcomes of radical nephroureterectomy: a series from the Upper Tract Urothelial Carcinoma Collaboration. Cancer 2009; 115:1224-33.
Moch H, Humphrey PA, Ulbright TM, Reuter VE. WHO Classification of Tumours of the Urinary System and Male Genital Organs. Geneva, Switzerland: WHO Press; 2016.
Mork M, Hubosky SG, Rouprêt M, et al. Lynch syndrome: a primer for urologists and panel recommendations. J Urol. 2015;194(1):21-29.
Olgac S, Mazumdar M, Dalbagni G, Reuter VE. Urothelial carcinoma of the renal pelvis: a clinicopathologic study of 130 cases. Am J Surg Pathol 2004; 28:1545-52.
Perez-Montiel D, Wakely PE, Hes O, Michal M, Suster S. High-grade urothelial carcinoma of the renal pelvis : clinicopathologic study of 108 cases with emphasis on unusual morphologic variants. Mod Pathol 2006; 19:494-503.
Reuter VE. Urinary bladder, ureter, and renal pelvis. In: Mills SE (ed.). Histology for pathologists. 3. ed. Philadelphia: Lippincott Williams & Wilkins, 2007.
Rouprêt M, Babjuk M, Compérat E, et al. European Association of Urology Guidelines on Upper Urinary Tract Urothelial Cell Carcinoma: 2015 update. Eur Urol. 2015;68(5):868-879.
Voltar para a página inicial do manual