Alexandre Muxfeldt Ab’Saber, Carlos Alberto Ribeiro, Ester Nei Aparecida Martins Coletta, Júlio De Faveri e Vera Luiza Capelozzi
I. Identificação e resumo clínico
II. Material enviado
- Lobectomia
- Direito
- Segmentectomia
- Esquerdo
- Pneumectomia
- Outro (especificar) __________________
III. Exame macroscópico
III.1 Localização do tumor
- Brônquio principal
- Lobo superior
- Lobo médio
- Direito
- Esquerdo
- Lobo inferior
III.2 Dimensões do tumor ___ x ___ x ___ cm
- Tumor ≤ 2 cm
- Tumor > 2 cm e ≤ 3 cm
- Tumor > 3 cm
Distância da margem cirúrgica brônquica ____ cm
Distância da pleura visceral ____ cm
IV. Exame microscópico
IV.1 Tipos histológicos (IASLC/ATS/ERS, 2011)
- Lesões pré-invasivas
- Hiperplasia adenomatosa atípica
- Adenocarcinoma in situ (antigo carcinoma bronquioloalveolar)*
- Não mucinoso (lepídico)
- Mucinoso
- Misto (mucinoso/não mucinoso)
- Adenocarcinoma minimamente invasivo*
- Não mucinoso (lepídico)
- Mucinoso
- Misto (mucinoso/não mucinoso)
- Adenocarcinoma invasivo
- Predominantemente lepídico (antigo carcinoma bronquioloalveolar não mucinoso com área invasiva > 5 mm)
- Predominantemente acinar
- Predominantemente micropapilar
- Predominantemente papilar
- Predominantemente sólido
- Variantes: fetal bem diferenciado, sólido com formação de muco, anel de sinete, cistadenoma mucinoso, adenocarcinoma de células claras
- Carcinoma de não pequenas células*
- Carcinoma de células escamosas (carcinoma epidermoide, carcinoma espinocelular)
Variantes: papilar, células claras, células pequenas, basaloide - Carcinoma de pequenas células
Variante: carcinoma de pequenas células combinado (com escamoso e/ou adenocarcinoma e/ou grandes células) - Carcinoma de grandes células
Variantes: carcinoma de grandes células neuroendócrino, carcinoma de grandes células neuroendócrino combinado, carcinoma basaloide, carcinoma de células claras, carcinoma linfoepitelioide-símile, carcinoma de grandes células com fenótipo rabdoide - Carcinoma adenoescamoso
- Tumor carcinoide
- Tumor carcinoide atípico
- Carcinoma pleomórfico com elementos sarcomatoides
- Carcinoma adenoide cístico
- Carcinoma mucoepidermoide
- Outros (linfomas, metástases, neoplasias raras)
* Nota 1: A expressão “adenocarcinoma in situ” substitui a anterior “carcinoma bronquioloalveolar”. Essa alteração está correlacionada ao tratamento específico dos adenocarcinomas e ao melhor prognóstico desta entidade.
* Nota 2: O diagnóstico de adenocarcinoma minimamente invasivo é reservado para lesões de padrão lepídico, com tamanho menor ou igual a 3 cm, nas quais é possível identificar uma área invasiva menor ou igual a 5 mm. Esse diagnóstico deve ser feito em peças cirúrgicas.
* Nota 3: A expressão “carcinoma de não pequenas células” deve ser evitada e reservada para situações em que não é possível caracterizar um subtipo histológico bem definido, como carcinoma epidermoide ou adenocarcinoma. Muitas vezes, essa expressão é utilizada para espécimes pequenos (biópsias brônquicas) em que mesmo o exame complementar de imuno-histoquímica não consegue definir o subtipo histológico.
IV.2 Brônquio principal (margem cirúrgica)
- Não pode ser aplicado
- Sem acometimento tumoral
- Acometido por carcinoma in situ
- Acometido por carcinoma invasivo
IV.3 Graduação Grau histopatológico
- Gx – O grau não pode ser avaliado
- G1 – Bem diferenciado
- G2 – Moderadamente diferenciado
- G3 – Pouco diferenciado
- G4 – Indiferenciado
V. Marcadores histológicos de prognóstico
- Necrose ausente
- Necrose presente em ____ % do tumor
- Relação núcleo/citoplasma aumentada
- Relação núcleo/citoplasma diminuída
- Vascularização peritumoral aumentada
- Vascularização peritumoral diminuída
- Inflamação peritumoral presente
- Inflamação peritumoral ausente
- Contagem de mitoses ( /10 CGA)
VI. Infiltração vascuIar
- Sanguínea
- Ausente
- Presente
- Não avaliável
- Linfática
- Ausente
- Presente
- Não avaliável
VII. Invasão perineural
- Presente
- Ausente
VIII. Comprometimento pleural
- Livre de comprometimento neoplásico
- O tumor estende-se ao tecido subpleural, porém não compromete a superfície pleural
- O tumor compromete a superfície da pleura visceral
- O tumor envolve a parede torácica
- Outro (especificar) _____________________
IX. Associação com carcinoma in situ
- Presente
- Ausente
X. Pulmão não neoplásico
- Sem alterações histológicas
Com as seguintes alterações histológicas
- Pneumonia obstrutiva focal
- Pneumonia obstrutiva extensa
- Atelectasia focal
- Atelectasia extensa
- Alterações enfisematosas
- Fibrose
- Outras (especificar) _________________
XI. Linfonodos (Figura 1 e Tabela 1)
- Ausência de metástases
- Metástases em ___ de ___ linfonodos coletados (especificar quantidades)
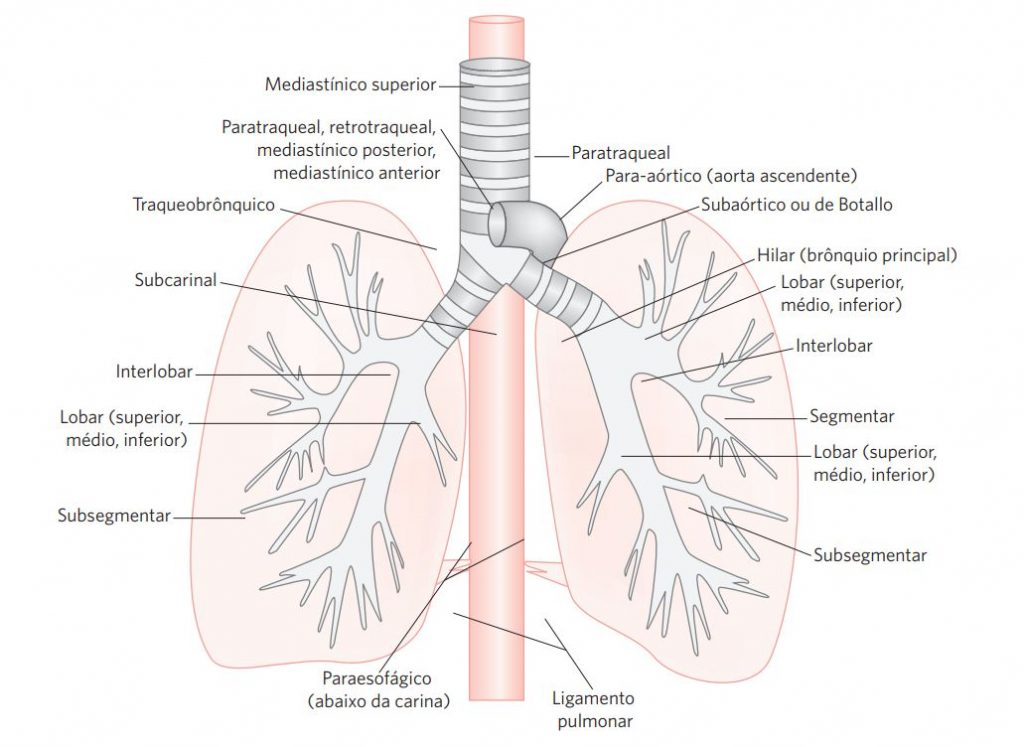
Figura 1 Localização dos linfonodos no pulmão.
Tabela 1 Subdivisão de linfonodos torácicos.
| Local | Direito | Esquerdo |
|---|---|---|
| Mediastino apical (superior) | Presente Ausente |
Presente Ausente |
| Paratraqueal | Presente Ausente |
Presente Ausente |
| Pré-traqueal | Presente Ausente |
Presente Ausente |
| Mediastino anterior | Presente Ausente |
Presente Ausente |
| Retrotraqueal (mediastino posterior) | Presente Ausente |
Presente Ausente |
| Traqueobrônquico subaórtico | Presente Ausente |
Presente Ausente |
| Para-aórtico (aorta ascendente) | Presente Ausente |
Presente Ausente |
| Subcarinal | Presente Ausente |
Presente Ausente |
| Paraesofágico (abaixo da carina) | Presente Ausente |
Presente Ausente |
| Ligamento pulmonar | Presente Ausente |
Presente Ausente |
XII. Exame de congelação
- Não realizado
- Realizado
- Do tumor
- Negativo
- Positivo
- Inconclusivo
- Da margem
Especificar ___________________- Negativo
- Positivo
- Inconclusivo
- De outro tecido
Especificar ____________________- Negativo
- Positivo
- Inconclusivo
XIII. Estudos especiais
XIII.1 Imuno-histoquímica
- Não realizada
- Realizada
Resultado _____________________
XIII.2 Biologia molecular
- Não realizada
- Realizada
Resultado _____________________
XIII.3 Morfometria
- Não realizada
- Realizada
Resultado _____________________
XIII.4 Microscopia eletrônica
- Não realizada
- Realizada
Resultado _____________________
XIV. Diagnóstico final (exemplo)
XIV.1 Produto de lobectomia superior do pulmão esquerdo
Adenocarcinoma predominantemente acinar, moderadamente diferenciado (G2) acometendo brônquio principal, medindo 2 x 1,8 x 1 cm. Margem cirúrgica brônquica livre. Pleura livre de comprometimento neoplásico.
Presença de necrose em 15% do tumor. Relação núcIeo/citoplasma aumentada.
Vascularização peritumoral aumentada. Inflamação peritumoral ausente. Presença de 3 mitoses/10 CGA.
Ausência de invasões angiolinfática e perineural.
Pulmão não neoplásico com focos de pneumonia lipoídica.
Ausência de metástases em 10 dos 10 linfonodos dissecados.
Estadiamento patológico: pTla, pN0, pM0.
XV. Patologista responsável
Assinatura ______________________
CRM __________________ Data ____ /____ /____
XVI. Estadiamento patológico (AJCC/UICC TNM, 2012) (Tabela 2)
pT – Tumor primário
- pTX – O tumor primário não pode ser avaliado ou há tumor detectado pela presença de células malignas no escarro ou lavado brônquico, mas não visualizado pela radiologia ou broncoscopia
- pTO – Não há evidência de tumor primário
- pTis – Carcinoma in situ
- pTIa – Tumor com 2 cm ou menos em sua maior dimensão, circundado por pulmão ou pleura visceral e sem evidência broncoscópica de invasão mais proximal que o brônquio lobar
- pT1b – Tumor maior do que 2 cm, porém menor ou igual a 3 cm em sua maior dimensão, circundado por pulmão ou pleura visceral e sem evidência broncoscópica de invasão mais proximal que o brônquio lobar
- pT2a – Tumor maior do que 3 cm, porém menor ou igual a 5 cm em sua maior dimensão, circundado por pulmão ou pleura visceral e sem evidência broncoscópica de invasão mais proximal que o brônquio lobar, ou tumor com 5 cm ou menor na maior dimensão com invasão das seguintes estruturas: envolvendo brônquio principal; 2 cm ou mais distal à carina; invadindo pleura visceral; associado com atelectasia ou pneumonite obstrutiva que se estende para a região hilar, mas não compromete todo o pulmão
- pT2b – Tumor maior do que 5 cm, mas menor do que 7 cm na maior dimensão
- pT3 – Tumor maior do que 7 cm ou tumor de qualquer tamanho com invasão direta das seguintes estruturas:
- Parede torácica (incluindo sulco superior)
- Diafragma
- Pleura mediastinal
- Pericárdio parietal
- Tumor no brônquio principal com menos de 2 cm distal à carina
- Tumor associado à atelectasia ou pneumonia obstrutiva de todo o pulmão
- pT4 – Tumor de qualquer dimensão, que invade quaisquer das seguintes estruturas:
- Mediastino, coração, grandes vasos, traqueia, esôfago, corpo vertebral, carina ou tumor com derrame pleural maligno
pN – Linfonodos acometidos
- pNx – Linfonodos não podem ser acessados
- pN0 – Ausência de metástases para linfonodos regionais
- pN1 – Metástases para linfonodo peribrônquico ipsilateral e/ou linfonodos hilares ipsilaterais, incluindo linfonodos intrapulmonares envolvidos diretamente por extensão do tumor primário
- pN2 – Metástases para linfonodos ipsilaterais mediastinais ou subcarinais
- pN3 – Metástases para linfonodos contralaterais mediastinais, contralateral hilar, ipsilateral ou contralateral e escaleno ou linfonodos supraclaviculares
pM – Metástases a distância
- pMx – Não podem ser acessadas
- pM0 – Ausência de metástases a distância
- pM1 – Metástase a distância: especificar o sítio
- pM1a – Presença de metástases, nódulos tumorais em diferentes lobos (contralateral); nódulos pleurais malignos, líquido pleural ou pericárdico com células neoplásicas malignas; especificar o sítio anatômico
- pM1b – Metástase a distância
Tabela 2 Estadiamento combinado para carcinoma de pulmão.
| Estádio | T | N | M |
|---|---|---|---|
| Carcinoma oculto | TX | N0 | M0 |
| 0 | Tis | N0 | M0 |
| IA | Tia T1b |
N0 N0 |
M0 M0 |
| IB | T2a | N0 | M0 |
| IIA | T1a T1b T2a T2b |
N1 N1 N1 N0 |
M0 M0 M0 M0 |
| IIB | T2b T3 |
N1 N0 |
M0 M0 |
| IIIA | T1a T1b T2a T2b T3 |
N2 N2 N2 N2 N1-2 |
M0 M0 M0 M0 M0 |
| IIIB | Qualquer T T4 |
N3 N2-3 |
M0 M0 |
| Estádio IV | Qualquer T | Qualquer N | M1a ou M1b |
Fonte: adaptada de AJCC/UICC, 2012.
XVII. Macroscopia
XVII.1 Biópsias cirúrgicas
As biópsias cirúrgicas incluem ressecções pulmonares de lesões neoplásicas ou não neoplásicas. Essas biópsias costumam ser realizadas na periferia dos lobos pulmonares.Em geral, esses fragmentos são recobertos por pleura visceral. Em virtude de seu tamanho reduzido e da localização periférica, raramente estão presentes linfonodos e estruturas brônquicas maiores.
A linha cirúrgica representada pelo stapler representa macroscopicamente a margem da peça. É necessário documentar as dimensões do espécime, bem como as características da superfície pleural.
A fixação e a distensão podem ser conseguidas facilmente com infusão de solução de formalina com agulha fina diretamente no espécime. Deve-se tomar cuidado para não distender demais o espécime, o que prejudicaria o exame anatomopatológico. Não se deve remover muito parênquima pulmonar com os staplers, pois estes se apresentam adjacentes às margens cirúrgicas (Figura 2).
Após essa etapa, secar a peça e pintar o parênquima exposto com tinta-da-china, estabelecendo assim a margem cirúrgica. Realizam-se, então, os cortes seriados do espécime no sentido longitudinal em um plano perpendicular à linha de ressecção (Figura 2).
Depois de seccionado, observar macroscopicamente a peça, anotando os eventuais achados. No caso de lesões neoplásicas, é importante anotar o tamanho da lesão, a superfície de corte, a relação do tumor com a pleura visceral e o parênquima adjacente, bem como a distância entre a lesão e a margem cirúrgica. Representam-se então um a quatro cortes da lesão (dependendo do tamanho desta), cujas secções demonstrem a relação da lesão com a pleura, com o parênquima adjacente e a margem de ressecção cirúrgica. Adicionam-se, ainda, dois cortes de parênquima não neoplásico. Para lesões não neoplásicas, deve-se representar o maior número de cortes possível, com especial atenção às lesões observadas macroscopicamente.
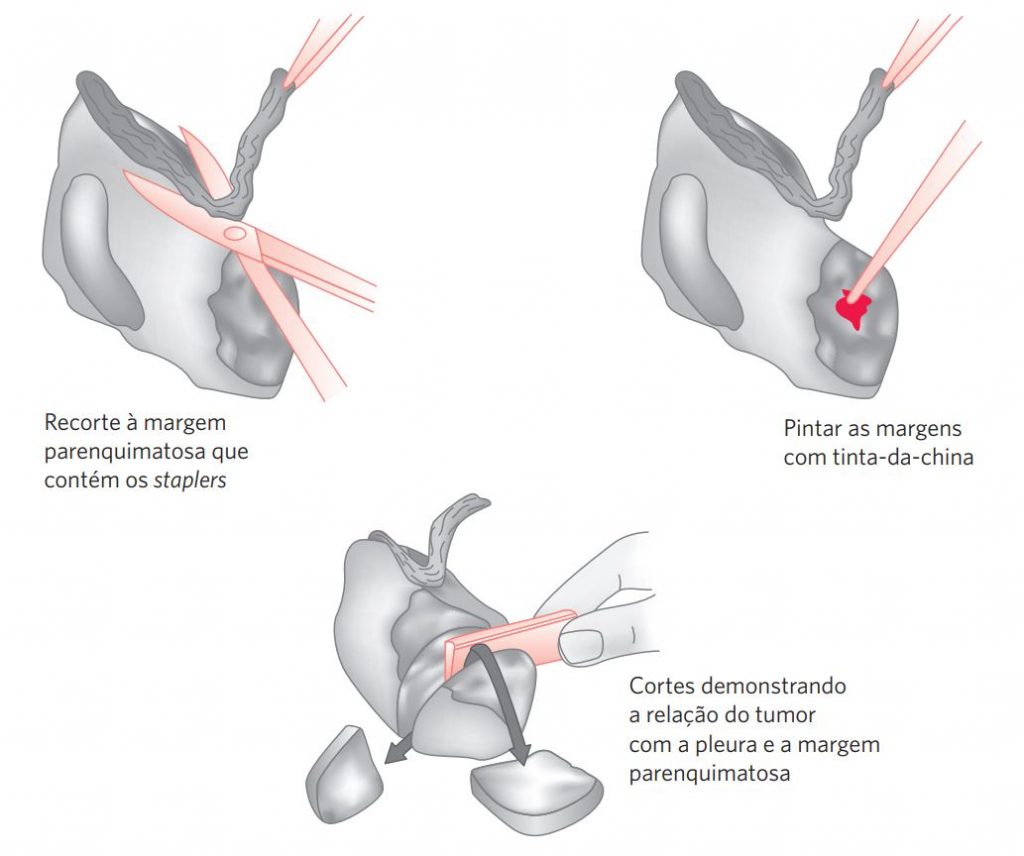
Figura 2 Procedimentos para biópsia pulmonar cirúrgica – orientação técnica.
XVII.1.1 Resumo dos procedimentos para biópsias pulmonares cirúrgicas
- Remover a linha de stapler.
- Pintar a margem cirúrgica e a pleura adjacente à lesão.
- Representar o parênquima com cortes perpendiculares à linha de ressecção, documentando o tamanho do tumor.
- Representar cortes do tumor demonstrando sua relação com a margem cirúrgica e a pleura. Representar o pulmão não neoplásico.
Cortes por congelação de porções representativas do tecido pulmonar podem ser feitos em pacientes com quadros clínicos graves. Colorações de rotina para doenças infecciosas podem ser feitas nos cortes por congelação, para pesquisa de Pneumocystis jiroveci (carinii) e fungos. Similarmente, em quadros sugestivos de malignidade ou toxicidade a drogas, os cortes por congelação podem permitir a instituição de medidas terapêuticas com rapidez. Na Figura 2, estão listados os procedimentos recomendados para biópsia pulmonar a céu aberto.
XVII.1.2 Procedimentos recomendados para biópsias pulmonares cirúrgicas
• Tecido recebido a fresco em solução salina.
• Cortes por congelamento.
• Amostras colhidas para:
• Microbiologia e virologia (esfregaços e cultura).
• Glutaraldeído para microscopia eletrônica.
• Congelamento rápido em nitrogênio líquido e estoque a –70°C.
• Tecido remanescente fixado em formalina: processamento de rotina.
• Estudos posteriores se houver indicação:
• Colorações especiais.
• Imunofluorescência.
XVII.2 Lobectomias e pneumectomias (lesões não neoplásicas)
- Orientar a peça de acordo com a requisição do exame anatomopatológico, conferindo se o espécime enviado corresponde ao lado direito ou esquerdo. Lembrar que a identificação do pulmão direito é feita pela presença de duas fissuras, três lobos e três brônquios lobares.
- Pesar o espécime e, após orientação na prancha de cortiça, medir o comprimento, a largura e a espessura (peso habitual: pulmão esquerdo, 370 g; pulmão direito, 450 g).
- Exame macroscópico da pleura: observar superfície, brilho e transparência, anotando alterações como áreas de retração, tumorações e espessamento. Qualquer tumoração deve sempre ser relacionada com o segmento pulmonar acometido.
- Consistência do pulmão como um todo: elástica, fibrosa ou esponjosa.
- Hilo pulmonar: identificar brônquios, vasos e linfonodos. Medir o coto brônquico principal e o tamanho médio dos linfonodos hilares. Dissecar e separar os linfonodos. Representar o coto brônquico separadamente. Abrir a árvore brônquica longitudinalmente com tesoura, expondo a luz dos brônquios lobares, observando o calibre, a mucosa e o conteúdo das estruturas. Registrar também dilatações, estenoses, ocIusões e espessamentos. Os vasos pulmonares devem ser abertos e o conteúdo examinado (tromboses, coágulos e embolias) (Figura 3).
- Parênquima pulmonar: efetuar cortes paralelos ao hilo pulmonar, equidistantes de 0,5 a 1 cm, sem dividir completamente o órgão. Examinar as superfícies de corte, identificando as lesões. Descrever: forma (nódulo, caverna), localização (lobo e segmento, se possível), relações com brônquio, vasos e pleura, medida, cor e consistência (Figura 3).
- Se possível, fazer esboço ou fotografar a lesão encontrada.
XVII.2.1 Cortes histológicos
• Lesão principal: 3 cortes.
• Pulmão adjacente: 1 corte por lobo.
• Corte transversal da parede brônquica: 1 corte.
• Linfonodos: 1 corte.
Nota: Para melhor análise histológica, recomenda-se insuflar o pulmão com formalina através da via respiratória principal e deixá-lo fixar durante a noite.
XVII.3 “Core biopsy”, lobectomias e pneumectomias (lesões neoplásicas)
- Orientar o espécime de acordo com a requisição do exame.
- Pesar a peça e, após orientação na prancha de cortiça, medir o comprimento, a largura e a espessura.
- Exame macroscópico da pleura. As lesões neoplásicas pulmonares podem ser classificadas em três tipos anatômicos principais: pleurais, periféricas e primárias do brônquio (centrais). Portanto, o exame macroscópico da superfície pleural deve ser minucioso, devendo-se anotar qualquer alteração de brilho, cor, consistência e transparência, bem como áreas de retrações ou abaulamentos e depósitos de fibrina, coágulos e material purulento. É importante também a análise das fissuras lobares (aderências, espessamentos, etc.).
- Consistência do pulmão como um todo: elástica, fibrosa ou esponjosa (palpar a peça procurando nódulos não visíveis externamente, tentando classificá-los como periféricos ou centrais).
- Hilo pulmonar:
a. Identificar cotos brônquicos, medi-los e pintar as margens com tinta-da-china. Realizar corte transversal de 3 mm de espessura e designar qual o segmento brônquico. Objetivo: avaliação histológica de comprometimento da margem por neoplasia.
b. Dissecar os linfonodos hilares, isoladamente, designando a qual segmento brônquico pertence. Realizar medida, observar aspecto externo e superfície de corte. Geralmente, os linfonodos hilares apresentam-se enegrecidos por causa do acúmulo de pigmento antracótico.
c. Vasos pulmonares: identificar veias e artérias. Abrir longitudinalmente com tesoura (ver Figura 3). Analisar o conteúdo (trombose, coágulo ou invasão por tumor). Pintar com tinta-da-china a íntima e retirar pequeno fragmento para histologia. Designar. Objetivo: avaliação histológica de comprometimento neoplásico da parede.
d. Vias respiratórias (brônquios): abrir longitudinalmente a árvore brônquica com tesoura, expondo a luz dos brônquios lobares até suas menores ramificações. Identificar lesões tumorais: forma, tamanho, cor, estenose do brônquio, infiltração da parede (medir), comprometimento do parênquima adjacente (dimensões). Sempre que possível, anotar qual o segmento acometido e a distância da lesão da margem brônquica. Verificar se o tumor compromete estruturas do hilo, da pleura ou outras ramificações (ver Figura 3).
e. Parênquima pulmonar: efetuar cortes paralelos com a faca, do ápice à base, equidistantes de 0,5 a 1 cm, sem dividir completamente o órgão (ver Figura 3C). Para os itens 1 a 3, a seguir, descrever tamanho, cor, cavitação, necrose, hemorragia, relação com os brônquios, com a pleura e limites com o parênquima adjacente, determinando qual o lobo acometido. Exame da superfície de corte: (1) lesão tumoral periférica; (2) extensão da lesão primária no brônquio; (3) múltiplas lesões disseminadas.
Nota: O exame da mucosa endobrônquica deve ser detalhado, pois alterações mínimas da mucosa podem corresponder a lesões pré-malignas.
XVII.3.1 Cortes histológicos
a. Tumor: 3 cortes
• Da massa principal.
• Da transição parede brônquica/tumor.
• Da transição tumor/parênquima pulmonar.
b. Parênquima não neoplásico: 3 cortes
• Da transição com a pleura (se possível, relação tumor/pleura).
• Distal ao tumor.
• De qualquer outra alteração encontrada.
c. Margem brônquica, arterial e venosa: pintados com tinta-da-china, 1 corte de cada
d. Linfonodos: 1 corte para cada estrutura encontrada
e. Estruturas adjacentes
Nota: Se houver costela associada, representá-la de acordo com o protocolo de macroscopia de fragmentos ósseos.
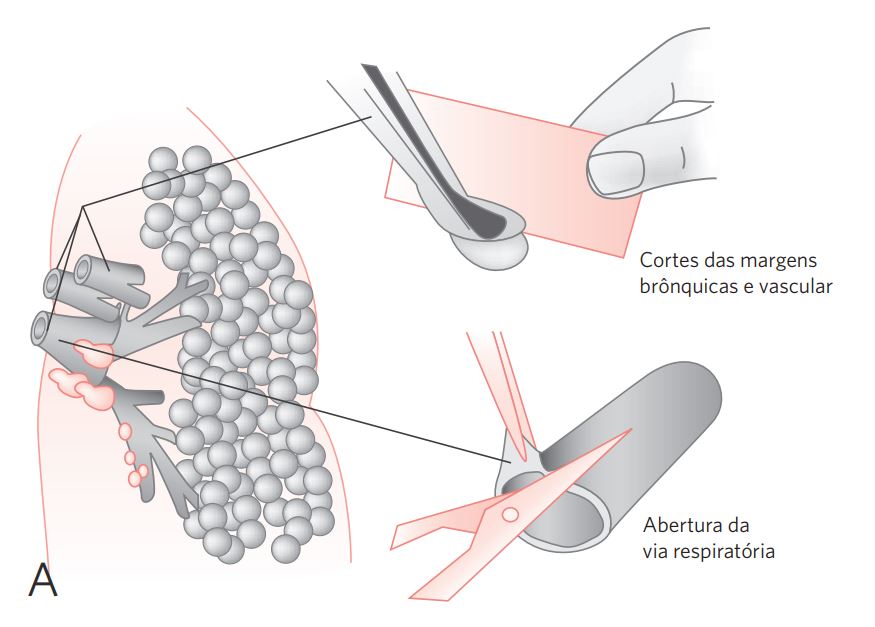
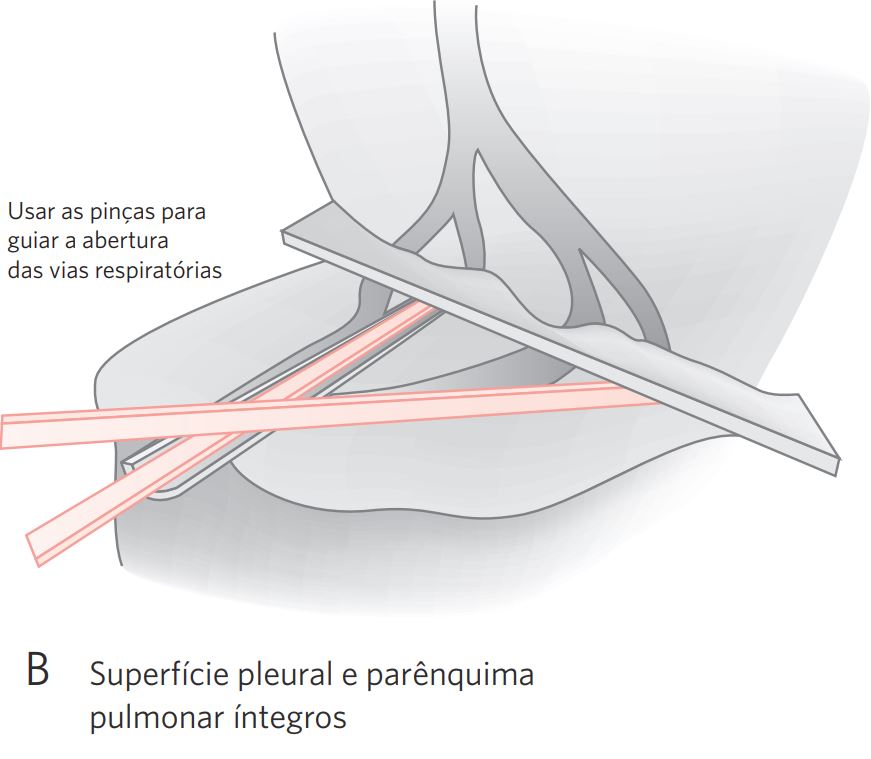
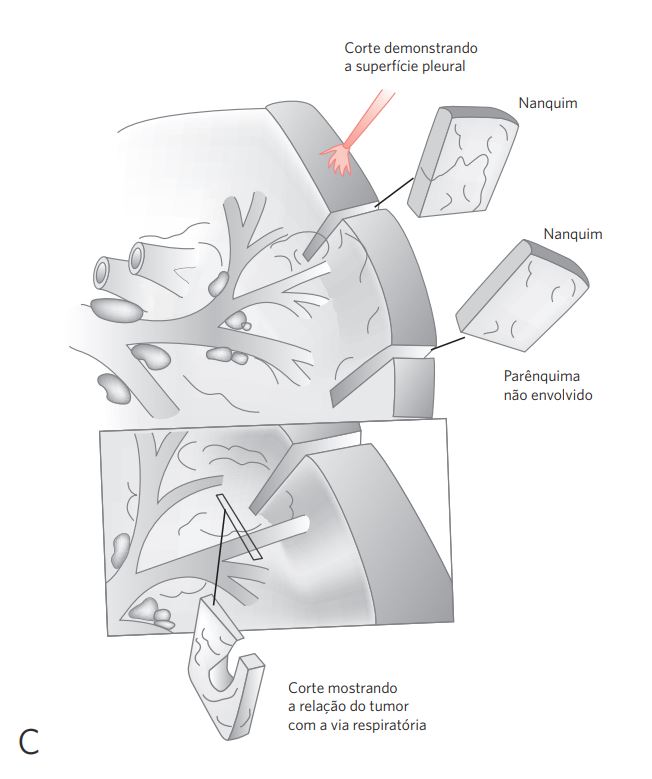
Figura 3 Procedimentos para lobectomias e pneumectomias.
XVII.3.2 Resumo (pneumectomias)
- Orientar o espécime (medir, pesar e descrever).
- Representar as margens brônquicas e vasculares marcadas com tinta-da-china.
- Pintar a pleura em região acima do tumor.
- Dissecar os linfonodos hilares.
- Abrir a árvore brônquica procurando o melhor plano para demonstrar a lesão encontrada.
- Relatar as características do tumor e suas relações com as estruturas adjacentes (pleura, brônquio, linfonodos hilares, etc.).
- Realizar os cortes histológicos.
XVIII. Protocolo para biomarcadores preditivos em câncer de pulmão
O novo protocolo do CAP/IASLC/AMP preconiza dois biomarcadores preditivos confirmados para a terapia-alvo do câncer de pulmão: (1) ativação de mutações do gene epidermal growth factor receptor (EGFR), o mais frequente em pacientes que respondem à terapia anti-EGFR (tyrosine kinase inhibitors ou TKIs: gefitinibe, erlotinibe, com cetuximabe e afatinibe em confirmação), e (2) a presença dos genes de fusão anaplastic lymphoma kinase (ALK) que preveem resposta à terapia anti-ALK (crizotinibe). A diretriz baseia-se em amplas revisões, grau de evidências e comentários. Embora haja outros biomarcadores preditivos para terapia-alvo em câncer de pulmão em investigação, o painel não dispõe de informações seguras para criar diretrizes com esses marcadores até o momento. É o caso do cetuximabe, indicado para pacientes com tumores cuja expressão é negativa para mutações do gene EGFR e KRAS ou fusão ALK.
XVIII.1 Quais pacientes devem ser submetidos a testes de biomarcadores preditivos?
Embora fosse da vontade de muitos oncologistas no Brasil que mais pacientes com câncer de pulmão tivessem a oportunidade de beneficiar-se com a terapia-alvo no contexto das evidências científicas, as diretrizes preconizam quais pacientes devem ser testados para EGFR e ALK. Certas características clínicas estão associadas com mutações do gene EGFR; mutações do gene EGFR são mais comuns em mulheres que nunca fumaram do que em homens, e entre asiáticas, mais do que em outros grupos étnicos. Os genes de fusão ALK são mais comuns em fumantes leves ou pacientes que nunca fumaram, em idade mais jovem, do que pacientes com câncer de pulmão sem fusão dos genes ALK. Todavia, se tais características forem estritamente seguidas como critérios para selecionar pacientes para testes de biomarcadores, então um número substancial de pacientes será excluído.
XVIII.2 Quais tipos histológicos de câncer de pulmão devem ser investigados para biomarcadores preditivos?
Mutações do gene EGFR e de genes de fusão ALK são mais detectadas em adenocarcinomas do que em outros tipos histológicos. Assim, o tipo histológico aparece como um critério razoável na seleção de pacientes que devem ser testados. No entanto, a utilização do tipo histológico – adenocarcinoma como critério para teste de pacientes – não é totalmente livre de controvérsias. Enquanto um reduzido número de carcinomas de células escamosas (CEC) tem sido reportado como apresentando mutações do gene EGFR na literatura, torna-se questionável se, de fato, trata-se de verdadeiros CEC, tornado-se equivocado ou não devidamente constatado que poucos CEC abriguem mutações do gene EGFR. Portanto, excluir CEC do teste não parece não razoável. Alguns tumores pulmonares reportados expressando mutação do gene EGFR positiva, como é o caso de alguns carcinomas de grandes células e alguns carcinomas glândula salivar-símiles, são provavelmente adenocarcinomas ou apresentam um componente adenocarcinomatoso. Se o tumor for um carcinoma adenoescamoso, um diagnóstico infrequente, o componente adenocarcinoma pode apresentar mutações do gene EGFR e responder à terapia-alvo.
XVIII.3 Espécimes limitados (sobretudo biópsias) são candidatos a testes de biomarcadores preditivos que devem ser priorizados
As evidências favorecem que adenocarcinomas de pulmão devam ser selecionados para testes de biomarcadores e que CEC e carcinomas de pequenas células não sejam candidatos aos testes. No entanto, deve-se levar em conta que a maioria dos diagnósticos de câncer de pulmão se baseia em pequenas biópsias ou citologias, espécimes limitados. Tais evidências sustentam a possível falha em se identificar um componente de adenocarcinoma em um câncer de pulmão ou de tipo misto. Mais ainda, uma considerável porcentagem de tumores de pulmão não tem material suficiente para classificação exceto como carcinomas de não pequenas células, mesmo após imuno-histoquímica complementar. Portanto, esses espécimes limitados são candidatos a testes de biomarcadores. Para tumores com tipo histológico indefinido, critérios clínicos e história anterior de adenocarcinoma podem conferir evidências para realização do teste. Depois do diagnóstico, os testes de biomarcadores preditivos devem ser prioritários. Dessa forma, perdas desnecessárias de tecido devem ser evitadas. Em alguns casos, pode ser necessário confirmar se se trata de um câncer primário de pulmão ou de uma metástase de outro órgão, o que pode ser alcançado pela imuno-histoquímica para evitar testes de biomarcadores desnecessários ou testar um biomarcador inadequadamente para um tipo de câncer. Em algumas circunstâncias, o oncologista pode solicitar uma rebiópsia para realização dos biomarcadores. Deve-se ter em mente que, atualmente, os biomarcadores têm demonstrado benefícios em pacientes com câncer de pulmão avançado, o que abrange a maioria dos casos. Ainda permanece indeterminado se a terapia-alvo é benéfica em pacientes com doença precoce.
XVIII.4 Quais espécimes podem ser testados para biomarcadores preditivos?
Os testes moleculares podem ser realizados em uma variedade de espécimes, dependendo do teste específico, incluindo tecido fixado em formalina, embebido em parafina, tecido congelado, aspirados, cell blocks, esfregaços e imprints. Em geral, o material é enviado para um laboratório especializado, e a quantidade de material a ser enviada depende do padrão seguido por cada laboratório.
XVIII.5 Qual é o papel do patologista?
Ao patologista cabe o papel crucial de selecionar a amostra para os testes: diferenciar câncer de tecido normal, diferenciar tecido viável e necrótico, selecionar amostragem adequada, diferenciar tipos histológicos e, ainda, pode sugerir testes moleculares com base no tipo histológico encontrado.
XVIII.6 Qual tipo de teste deve ser realizado?
Até o momento, a análise de mutação por sequenciamento (PCR) para o biomarcador EGFR e o teste de Fish para o biomarcador ALK têm demonstrado evidente relação com o prognóstico dos pacientes. Outros métodos têm sido defendidos, em particular a imuno-histoquímica com detecção de mutações específicas de anticorpos (EGFR – éxon 21 – L858R; EGFR – éxon 19 – delection; EGFR Flex), técnicas estas que poderão ser adotadas no futuro. Todavia, a correlação entre biomarcadores específicos com o prognóstico dos pacientes em estudos clínicos e a habilidade em se detectar mutações menos frequentes ou fusões têm apresentado dados relevantes para favorecer esses testes, em particular em detrimento de outros. Em futuro próximo, testes múltiplos e, eventualmente, análise de todo o genoma, poderão constituir fatores de impacto para os biomarcadores de câncer de pulmão.
XVIII.7 Linfoma versus pneumonia linfoide intersticial (LIP)
Uma das principais dificuldades diagnósticas da patologia pulmonar está correlacionada com a separação destas entidades (linfomas versus LIP). O tecido pulmonar normal apresenta grande quantidade de tecido linfoide, principalmente na forma de tecido linfoide associado ao brônquio (Balt), ou seja, tecido linfoide associado à mucosa respiratória, que tem como principal função a defesa do órgão contra patógenos externos. Ocorre que a hiperplasia do Balt é um evento benigno constantemente associado à LIP. Existe, assim, grande dificuldade em diferenciar a LIP, com intensa hiperplasia de Balt, de linfomas de baixo grau (baltomas), que são as neoplasias linfoides mais frequentes no pulmão. Atualmente, por meio da biologia molecular, pode-se realizar PCR no sentido de identificar o rearranjo do gene de cadeia (célula B) e do gene codificador do receptor da célula. Com essa técnica, o diagnóstico de clonalidade da célula linfoide é mais fidedigno, possibilitando o tratamento de linfomas de baixo grau precocemente com melhor prognóstico para o paciente.
XVIII.8 Carcinomas epidermoides
O estudo do gene SOX 2 está altamente correlacionado ao processo tanto de inicialização quanto de manutenção dos carcinomas epidermoides e, futuramente, pode corresponder a uma terapia-alvo eficaz.
Os carcinomas epidermoides demonstram alta frequência de mutações no p53(50 a 75%), mais do que todos os outros tipos de neoplasias pulmonares. O p53 é um gene de supressão tumoral que tem como principal função a parada do ciclo celular na fase G1 e, posteriormente, a indução da célula à apoptose. Em estágios de neoplasias precoces, mutações do p53 estão associadas à invasão tumoral. As displasias atípicas podem apresentar de 10 a 50% de anormalidades no p53.
XVIII.9 Carcinomas de pequenas células e tumores neuroendócrinos
Frequentemente, observam-se mutações dos genes supressores tumorais p53 e Rb (retinoblastoma), em cerca de 50 a 80% dos casos de carcinomas de pequenas células (CPC) e carcinomas de grandes células do tipo neuroendócrino.
Tumores carcinoides típicos não apresentam mutações no p53, enquanto nos tumores carcinoides atípicos ocorre superexpressão da proteína p53 em 20 a 40% dos casos, com raras mutações. CPC e carcinoma de grandes células do tipo neuroendócrino mostram baixa expressão de proteína Rb, o que é facilmente evidenciado pelo estudo imuno-histoquímico. A perda da heterozigose (LOH) na porção 13q14 do locus cromossômico do gene do Rb está altamente correlacionada com a perda de expressão da proteína Rb, tanto nos CPC quanto nos carcinomas de grandes células do tipo neuroendócrino. Carcinoides típicos não apresentam mutações no gene Rb. O aumento gradual das anormalidades moleculares ao longo do espectro dos tumores neuroendócrinos é concordante com o conceito de malignidade gradual destes tumores. Mutações no gene Ras não são evidenciadas em tumores neuroendócrinos.
XVIII.10 Carcinomas pleomórficos com elementos sarcomatoides
Poucos estudos têm identificado alterações moleculares neste grupo de tumores. Foi relatado que existe menor quantidade de mutações encontradas no gene p53 em carcinomas pleomórficos do que em adenocarcinomas. O achado de número idêntico de mutações no p53, tanto no componente epitelial quanto no componente de células fusiformes em carcinomas pleomóficos, corrobora a hipótese de histogênese monoclonal destes tumores.
XVIII.11 Tumores de partes moles
Para sarcomas primários de pulmão, são relatadas as mesmas alterações moleculares observadas em sarcomas de outras localidades anatômicas. Como exemplo, pode-se observar a translocação cromossomial t(X;18) para sarcomas sinoviais e a translocação cromossomial t(11;22) (q24;12), característica dos sarcomas de Ewing e do tumor neuroectodérmico primitivo (PNET).
XVIII.12 Marcadores prognósticos
Mutações no gene de proteínas de regulação da apoptose, como p21, p16, bcl-2 e bax, estão entre as mais frequentes no que diz respeito a neoplasias pulmonares; numerosos trabalhos com pesquisa nestes genes têm sido realizados com resultados importantes com relação ao prognóstico.
XVIII.13 Imuno-histoquímica
- Considerações iniciais: em neoplasias de pulmão, é de grande importância a separação dos carcinomas de pequenas células (CPC) e o carcinoma de não pequenas células (CNPC). Normalmente, essa divisão é realizada por dois pontos principais: (1) o prognóstico do CPC é bem pior do que do CNPC, e, quando o paciente é diagnosticado como portador de CPC, o tratamento de escolha é a quimioterapia; (2) a maioria dos CPC é diagnosticada por biópsia transbrônquica, não sendo necessária a biópsia a céu aberto. Assim, a separação inicial desses dois grupos é realizada em pequenas amostras de tecido (biópsia transbrônquica ou transtorácica).
- Atualmente, em razão dos avanços da biologia molecular e dos tratamentos específicos de EGFR para adenocarcinomas, é de grande importância a separação precoce de adenocarcinomas e carcinomas de células escamosas. Dessa maneira, quando possível, é necessário tentar separar os adenocarcinomas dos carcinomas de células escamosas, mesmo em biópsias pequenas.
- Antes da utilização de imuno-histoquímica, é sempre conveniente lembrar que colorações clássicas de histoquímica, como mucicarmim e PAS (com e sem diástase), são de grande utilidade na demonstração de células produtoras de muco, podendo assim separar facilmente os adenocarcinomas pouco diferenciados de carcinomas de pequenas células em amostras pequenas.
- Em amostras pequenas, deve-se ter grande cuidado em não desbastar completamente o bloco de parafina com a realização de lâminas em branco para estudo imuno-histoquímico. Por isso, sugere-se um painel reduzido no sentido de confirmar o carcinoma de pequenas células e ajudar no diagnóstico definitivo (Tabela 3).
Tabela 3 Painel imuno-histoquímico para pequenas biópsias brônquicas.
| Marcadores | Carcinoma de pequenas células | Adenocarcinomas | Carcinomas de células escamosas |
|---|---|---|---|
| Cromogranina A | Positivo em 50% | Positivo em 5% | Negativo |
| TTF-1 | Positivo em 94% | Positivo em 63% | Raramente positivo (10%) |
| Napsina-A | Negativo | Positivo em 75% | Raramente positivo (10%) |
| CEA monoclonal | Positivo em 39% | Positivo em 86% | Negativo |
| p63 | Negativo | Negativo | Positivo em 98% |
| CK5/6 | Negativo | Negativo | Positivo em 95% |
| Mucicarmim | Negativo | Positivo | Negativo |
5. É importante ressaltar que, hoje em dia, não se avalia a positividade dos diversos
marcadores como uma resposta simples: sim ou não. Como se observa na Tabela 3, a positividade varia de 0 a 95%, ou seja, é necessário cercar-se de todos os dados morfológicos clássicos, histoquímicos, imuno-histoquímicos e clínicos para chegar ao resultado final. Dessa maneira, nada impede que um carcinoma de não pequenas células seja cromogranina-positivo, muito embora essa situação seja bastante rara.
6. Quando se trabalha em material de peça cirúrgica, a situação muda um pouco. Já não é preciso ter cuidado em desbastar o bloco completamente, pois se conta com grande quantidade de material cirúrgico. Mesmo assim, algumas neoplasias não necessitam da realização do estudo imuno-histoquímico, como é o caso dos adenocarcinomas bem diferenciados, carcinomas de células escamosas bem diferenciados e carcinomas bronquioloalveolares, em que o simples aspecto clássico, revelado pela HE, é diagnóstico para o patologista experiente sem dificuldades.
7. De qualquer forma, muitas neoplasias pouco diferenciadas e outras, que exigem a realização do exame imuno-histoquímico por definição (como é o caso do carcinoma de grandes células do tipo neuroendócrino), a imuno-histoquímica deve ser realizada e com painel bastante amplo de preferência.
8. Sugere-se o painel a seguir para diferenciar as principais neoplasias pulmonares com material de peça cirúrgica (Tabelas 4 e 5).
Tabela 4 Imuno-histoquímica em biópsia a céu aberto de neoplasias primárias de pulmão.
| Tipo histológico | AE1/E3 | TTF-1 | Ber-EP4 | p63 | 34BE12 | 35BH11 | Cromogranina A | Mucicarmim |
|---|---|---|---|---|---|---|---|---|
| Carcinoma de grandes células | 96% | 75% | 9% | 0 | 17% | 23% | 0 | – |
| Adenocarcinomas primários | 100% | 73% | 92% | 0 | 57% | 99% | 5% | – |
| Carcinoma de células escamosas | 100% | 4% | 3% | 90% | 96% | 7% | 0 | – |
| Carcinoma de grandes células | 96% | 75% | 9% | 0 | 15% | 23% | 67% | – |
Tabela 5 Marcadores imuno-histoquímicos para as principais lesões metastáticas.
| Sítio primário | TTF-1 | CK7 | CK20 | CDX2 | Calretinina | Breast2 | Tireoglobulina |
|---|---|---|---|---|---|---|---|
| Pulmão | 94% | 89% | 9% | 0 | 12% | 2% | 0 |
| Tireoide | 100% | 100% | 0 | 0 | 28% | 0 | 100% |
| Mama | 0 | 94% | 0 | 0 | 11% | 77% | 0 |
| TGI | 1% | 14% | 89% | 97% | 18% | 0 | 0 |
| Pleura | 0 | 70% | 6% | 4% | 100% | 0 | 0 |
TGI: trato gastrointestinal.
Nota: Todos os anticorpos mostrados são sugestões. O patologista deve fazer correlações clinicomorfológicas e avaliar criteriosamente qual o painel imuno-histoquímico mais adequado para a neoplasia em estudo.
Bibliografia
Ab’Saber AM, Massoni MN, Bianchi CP, Ctens BB, Parra ER et al. Neuroendocrine and biologic features of primary tumors and tissue in pulmonary large cell carcinomas. Ann Thorac Surg 2004; 77:1883-90.
Ab’Saber AM. Relevância clínica dos carcinomas de grandes células pulmonares com relação às características neuroendócrinas, biomoleculares e estromais [tese]. São Paulo: Faculdade de Medicina da Universidade de São Paulo; 2003.
AJCC Cancer Staging. AJCC Cancer staging handbook. Lung. 7. ed. Chicago: AJCC, 2012. p. 253.
Borczuk AC, Toonkel RL, Powell CA. Genomics of lung cancer. Proc Am Thoracic Soc 2009; 6(2):152-8.
Cagle PT, Allen TC, Dacic S, Beasley MB, Borczuk AC, Chirieac LR et al. Revolution in lung cancer: new challenges for the surgical pathologist. Arch Pathol Lab Med 2011; 135(1):110- 6.
Cagle PT, Dacic S. Lung cancer and the future of pathology. Arch Pathol Lab Med 2011; 135(3):293-5.
Chrieac LR, Dacic S. Targeted therapies in lung cancer. Surg Pathol Clin 2010; 3(1):71-82.
Colby TV, Koss MN, Travis WD. Tumors of the lower respiratory tract. AFIP. Atlas of tumor pathology. 1995.
Dabbs DJ. Diagnostic immunohistochemistry. 2. ed. Churchill Livestone; 2010.
Dacic S, Shuai Y, Yousem S, Ohori P, Nikiforova M. Clinicopathological predictors of EGFR/KRAS mutational status in primary lung adenocarcinoma. Mod Pathol 2010; 23(2):159-68. Gal AA, Marchevsky A, Travis WD. Protocol applies to all invasive carcinomas of the lung. Based on AJCC/UICC TNM. 6. ed. 2004.
Greene FL, Page DL, Fleming ID, Fritz A, Balch CM, Haller DG. (eds.). AJCC cancer staging manual. 6. ed. New York: Springer, 2002.
Hirch FR, Wynes MW, Gandara DR, Bunn Jr PA. The tissue is the issue: personalized Medicine for non-small cell lung cancer. Clin Cancer Res 2010; 16(20):49009-11.
Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin 2011; 61(2):69-90.
Ladanyi M, Hogendoorn PC. Cancer biology and genomics: translating discoveries, transforming pathology. J Pathol 2011; 223(2):99-101.
Ladanyi M, Pao W. Lung anocarcinoma guiding EGFR-targeted therapy and beyond. Mod Pathol 2008; 21(Suppl 2):S16-22.
Mino-Kenudson M, Chirieac LR, Law K, Hornick JL, Lindeman N, Mark EJ et al. A novel, highly sensitive antibody allows the routine detection of ALK-rearranged lung adenocarcinomas by standard immunohistochemistry. Clin Cancer Res 2010; 16(5):1561-71. Moutain CF. The international system for staging lung cancer. Semin Surg Oncol 2000; 18(2):106-15.
Protocol for the examination of specimes from patients with primary non-small cell carcinomas, small cell carcinoma, or carcinoid tumor of the lung. Based on AJCC/UICC TNM. 7. ed. 2012.
Rekhtman NN, Paik PK, Arcila ME, Tafe LJ, Oxnard GR, Morreira AL et al. Calrifyng the spectrum of driver oncogene mutations in biomarker-verifeid squamous carcinoma of lung: lack of EGFR and presence of PIK3CA mutations. Clin Cancer Res 2012; 18(4):1167-76.
Sasaki T, Rodig SJ, Chirieac LR, Jainn PA. The biology and treatment of EML4-ALK non-small cell lung cancer. Eur J Cancer 2010; 46(10):1773-80.
Sholl LM, Xiao Y, Joshi V, Yeap BY, Cioffredi LA, Jackman DM et al. EGFR mutation is a better predictor of response to tyrosine kinase inhibitors in non-small cell lung carcinoma than Fish, Cish, and immunohistochemistry. Am J Clin Pathol 2010; 133(6):922-34.
Smouse JH, Cibas ES, Janne PA, Joshi VA, Zou KH, Lideman NI. EGFR mutations are detected comparably in citologic and surgical pathology specimens of specimens of nonsmall cell lung cancer. Cancer 2009; 117(1):67-72.
Solomon SB, Zakowski MF, Pao W, Thornton RH, Ladanyi M, Kris MG et al. Core needle lung biopsy specimens: adequacy for EGFR and KRAS mutational analysis. AJR Am J Roentgenol 2010; 194(1):266-9.
Taylor BS, Ladanyi M. Clinical cancer genomic: how soon is now? J Pathol 2011; 223(2):318- 26.
Thérialt C, Brousset P. PCR analysis of immunoglobulin heavy chain (IgH) and TCR-y chain gene rearrangements in the diagnosis of lymphoproliferative disorders. Mod Pathol 2000; 13:(12)1269-79.
Travis WD, Brambilla E, Noguchi M, Nicholson AG. International Association for the Study of Lung Cancer/American Thoracic Societt/European Respiratory Society International Multidiscplinary Classification os Lung Adenocarcinoma. J Thoracic Oncology 2011; 6(2):244-85.
World Health Organization (WHO). USCAP 2012 companion meeting, Vancouver, Canada. Lung cancer molecular testing. Histological typing of lung tumors. 3. ed. Geneva: WHO, 1999.
World Health Organization (WHO). Histological typing of lung tumors. 4. ed. Geneva: WHO, 2004.
Youlden DR, Cramb SM, Baade PD. The international epidemiology of lung cancer: geographical distribuition and secular trends. J Thoracic Oncol 2008; 3(8):819-31.
Voltar para a página inicial do manual