Athanase Billis
Código de topografia
C61 Neoplasia maligna da próstata
I.Identificação e resumo clínico
II. Dados clínicos relevantes
III. Procedimento
- Biópsia de agulha
- Ressecção transuretral (RTU)
- Prostatectomia aberta (nodulectomia)
- Prostatectomia radical
- Outro (especificar) __________IV
IV. Biópsia de agulha
PSA ______ ng/mL
Toque retal
Ultrassonografia
Bloqueio hormonal
- Sim
- Não
Radioterapia
- Sim
- Não
Estádio clínico
- T1c
- T2
IV.1 Achados microscópicos
- Sem alterações
- Atrofia
- Infiltrado inflamatório inespecífico
- Infiltrado inflamatório granulomatoso
- Neoplasia intraepitelial prostática (NIP)
- Outras lesões (especificar) ___________
IV.2 Achados microscópicos relacionados ao fragmento com adenocarcinoma
- Extensão linear do fragmento em mm _____
- Extensão linear do adenocarcinoma em mm ____ e percentual _____
- Gleason _____ + _____ = ______
- Extensão extraprostática
- Invasão perineural
- Invasão vascular
- Efeito de bloqueio hormonal
- Efeito radioterápico
- Suspeito, mas não diagnóstico de adenocarcinoma
IV.3 Tipos histológicos de adenocarcinoma
- Adenocarcinoma acinar usual
- Adenocarcinoma ductal
- Carcinoma urotelial infiltrativo
- Carcinoma urotelial in situ
- Adenocarcinoma mucinoso
- Adenocarcinoma de células em sinete
- Adenocarcinoma de células espumosas
- Adenocarcinoma pseudo-hiperplásico
- Carcinoma de pequenas células com ou sem diferenciação neuroendócrina
- Carcinoma sarcomatoide ou carcinossarcoma
- Carcinoma epidermoide e/ou adenoescamoso
- Tumor de células basais
- Carcinoma linfoepitelioma-símile
- Carcinoma pleomórfico de células gigantes
- Outro (especificar) ___________
IV.4 Elaboração do laudo
Os achados de cada fragmento devem ser descritos separadamente. Exemplo: L1 – sem particularidades; L2 – atrofia focal sem outras alterações dignas de nota; L3 – adenocarcinoma acinar usual Gleason 3 + 3 = 6 na extensão de 1 mm em fragmento com cerca de 15 mm de comprimento (aproximadamente 6%); L4 – adenocarcinoma acinar usual Gleason 3 + 4 = 7 na extensão de 5 mm em fragmento com cerca de 15 mm de extensão (aproximadamente 33%), etc. O urologista considera, para fins de conduta, os maiores grau histológico ou contagem de Gleason.
V. Ressecção transuretral (RTU) ou prostatectomia aberta
Número total de fragmentos ____
Número de fragmentos com carcinoma _____ percentual _____
Estádio
- T1a
- T1b
VI. Prostatectomia radical
PSA pré-operatório ____ ng/mL
Estádio clínico
- T1a
- T1b
- T1c
- T2
- T3
Medicação neoadjuvante
- Sim
- Não
Preservação do feixe vasculonervoso
- Sim
- Não
- À direita
- À esquerda
- Bilateralmente
VI.1 Exame macroscópico
Peso ____ g
Tamanho ___ x ___ x ___ cm
Tumor
Localização ___________
Dimensões ___ x ___ x ___ cm
Nódulos hiperplásicos
- Presentes
- Ausentes
Outros achados (especificar) _____________
VI.2 Achados microscópicos
- HNP (nódulos hiperplásicos estromatoglandulares e/ou estromatosos)
- Infiltrado inflamatório inespecífico
- Infiltrado inflamatório granulomatoso
- Neoplasia intraepitelial prostática (NIP)
- Margem cirúrgica vesical comprometida
- Número de fragmentos comprometidos ____
- Margem cirúrgica apical comprometida
- Número de fragmentos comprometidos ____
- Margem cirúrgica circunferencial comprometida
- Número de fragmentos (ou quadrantes) comprometidos ____
- Invasão do ápice (pT2)
- Invasão microscópica do colo vesical (pT3a)
- Extensão extraprostática (pT3a)
- Invasão de vesícula seminal (pT3b)
- Metástase linfonodal
- Outros achados (especificar) _____________
VI.2.1 Tipo histológico (ver item IV)
VI.2.2 Grau histológico (Gleason)
- ____ + ____ = ____
- Grau terciário ______
VI.2.3 Extensão tumoral
- Tumor muito limitado
- Tumor limitado
- Tumor moderadamente extenso
- Tumor extenso
- Tumor muito extenso
VI.2.4 Desenho esquemático mostrando os principais achados
A Figura 1 mostra as vesículas seminais direita e esquerda (VSD e VSE), ductos deferentes direito e esquerdo (DD e DE), oito fragmentos da margem cirúrgica vesical (MB), oito fragmentos da margem cirúrgica apical (uretral) (MU) e oito fatias transversais do parênquima prostático divididas em quatro quadrantes, nos quais estão desenhados oito pontos equidistantes. A linha contínua representa a extensão extraprostática; a linha pontilhada, a margem cirúrgica comprometida. Nesse exemplo, o carcinoma prostático ocupa 21 pontos positivos em quadrantes situados à direita e à esquerda, mostra extensão extraprostática no quadrante D14 e margem cirúrgica comprometida no quadrante D12. Há invasão da porção proximal da vesícula seminal direita e presença de tumor em dois fragmentos obtidos do cone vesical, dos quais um apresenta também comprometimento da margem cirúrgica.
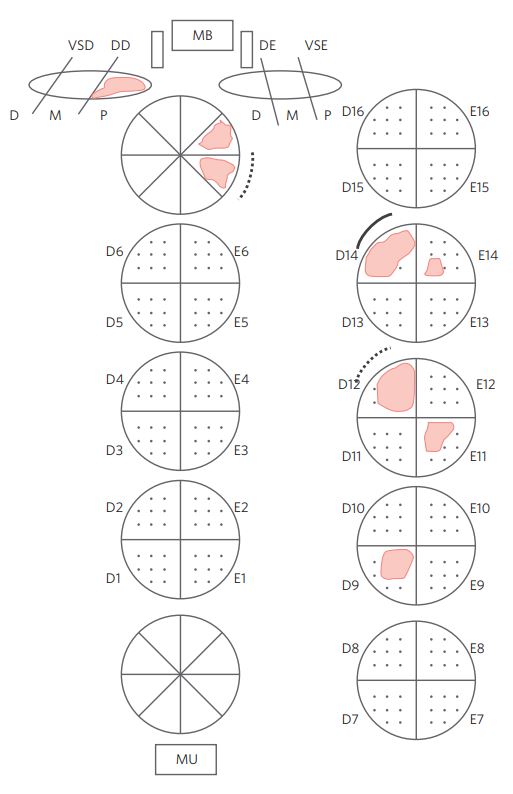
Figura 1 Achados anatomopatológicos em uma prostatectomia radical.
VI.2. 5 Exemplo de laudo anatomopatológico baseado nos achados do desenho esquemático da Figura 1
Adenocarcinoma da próstata acinar usual Gleason 4 + 3 = 7 (grau terciário: 5) em 5 quadrantes do total de 40 examinados (3 à direita e 2 à esquerda) ocupando 21 pontos positivos (tumor moderadamente extenso).
Extensão extraprostática no quadrante D14 e margem cirúrgica comprometida no quadrante D12. Invasão da porção proximal da vesícula seminal direita. Presença tumoral em dois fragmentos do colo vesical um deles com margem cirúrgica comprometida.
Neoplasia intraepitelial prostática (NIP) frequente e extensa. Hiperplasia nodular da próstata (nódulos hiperplásicos estromatoglandulares e estromatosos).
Seis linfonodos enviados para exame de congelação e posteriormente incluídos em parafina, livres de neoplasia.
Patologista responsável _____________
Assinatura _____________
CRM _____________ Data: ___/___ /___
VII. Estadiamento TNM (AJCC, 2a ed., 2017)
pT – Tumor primário
- pTX – Tumor primário não pode ser avaliado
- pTO – Não há evidência de tumor primário
- T1 – O tumor é um achado histológico incidental, não é palpável ao toque retal ou visualizado por técnicas de imagenologia
- T1a – Tumor em 5% ou menos do tecido ressecado
- T1b – Tumor em mais de 5% do tecido ressecado
- T1c – Tumor identificado em biópsia por agulha (PSA elevado, mas tumor não palpável ao toque e não visualizado por técnicas de imagenologia)
- pT2 – Tumor limitado à próstata
- pT2a – O tumor compromete até metade de um lobo, ou menos
- pT2b – O tumor compromete mais da metade de um lobo, porém não ambos os lobos
- pT2c – O tumor compromete ambos os lobos
- pT3 – O tumor se estende além da próstata
- pT3a – Extensão extraprostática (unilateral ou bilateral); inclui comprometimento microscópico do colo vesical
- pT3b – O tumor invade a(s) vesícula(s) seminal(is)
- pT4 – O tumor está fixo ou invade outras estruturas adjacentes que não a vesícula seminal: esfíncter externo, reto, músculos elevadores ou parede pélvica
pN – Linfonodos regionais
- pNX – Linfonodos regionais não podem ser avaliados
- pNO – Ausência de metástases em linfonodos regionais
- pN1 – Metástase(s) em linfonodo(s) regional(is)
pM – Metástases à distância (M)
- pMO – Ausência de metástases à distância
- pM1 – Metástases à distância
- M1a – Linfonodo(s) não regional(is)
- M1b – Osso(s)
- M1c – Outra(s) localização(ões)
Nota 1: As categorias pT, pN e pM correspondem às categorias clínicas T, N e M. Não há, entretanto, a categoria pT1 (pT1a, pT1b ou pT1c), porque o tecido amostrado é insuficiente para determinar a maior categoria pT.
Nota 2: Desde a versão de 2009 do TNM, a invasão microscópica do colo vesical é estádio pT3a (Billis et al., 2004); invasão do ápice, entretanto, é pT2.
VIII. Comentários
VIII.1 Biópsia de agulha
VIII.1.1 Obtenção e envio do material
A biópsia é feita em sextante e dirigida à zona periférica da próstata por meio de ultrassonografia. A biópsia deve ser estendida, isto é, fornecer 8 a 12 fragmentos (preferencialmente 12) das 6 regiões: apical, mediana e basal bilateralmente (2 basais, 2 medianos e 2 apicais de cada lado).
As biópsias devem ser enviadas em frascos separados devidamente identificados de acordo com o local biopsiado. Os fragmentos de um mesmo sextante podem ser colocados em um mesmo frasco, mas, preferencialmente, devem também ser enviados em frascos separados. O patologista deve incluir, no máximo, dois fragmentos por bloco, mesmo que tenha recebido todos no mesmo frasco. Obrigatoriamente, as áreas suspeitas ao exame ultrassonográfico (nódulo, área de hiperfluxo ao Doppler em cores, etc.) devem ser biopsiadas e enviadas também em frascos separados devidamente identificados. Em alguns casos selecionados, as vesículas seminais são biopsiadas. A ressonância magnética mostra-se superior à ultrassonografia na avaliação de eventual invasão das vesículas seminais. A devida identificação do local biopsiado tem grande importância em casos de “suspeito, mas não diagnóstico de adenocarcinoma”.
VIII.1.2 Representatividade do material e informações clínicas
Sabendo-se que os fragmentos obtidos em uma biópsia prostática têm um comprimento máximo de 2 cm, qual seria a extensão mínima para um fragmento ser representativo? Não existe esse valor; entretanto, fragmentos menores que 1 cm seriam insatisfatórios e abaixo de 0,5 cm não representativos. Assim sendo, é importante que conste no laudo o comprimento de cada um dos fragmentos enviados, devendo o patologista consignar em uma nota adicional quando o material não for representativo.
Outro aspecto importante é o número de cortes presentes em cada lâmina. É imprescindível que haja um número razoável de cortes na lâmina, porque, muitas vezes, o carcinoma é muito pequeno e focal, sendo detectado apenas em um único corte presente na lâmina. Não se deve, entretanto, exagerar no número de cortes para não desbastar totalmente o bloco de parafina e, consequentemente, não ter material para eventual estudo imuno-histoquímico posterior.
As informações clínicas devem fornecer idade do paciente, níveis de PSA, achados do toque retal e da ultrassonografia, eventual irradiação prévia e vigência de bloqueio hormonal. Estas duas últimas informações são cruciais para a interpretação adequada das lesões; elas causam alterações morfológicas que dificultam estabelecer o grau histológico e o próprio diagnóstico de adenocarcinoma.
VIII.1.3 Rebiópsia
A rebiópsia está indicada em casos de “suspeito, mas não diagnóstico de adenocarcinoma”. Nas rebiópsias, o número de fragmentos enviados deve ser ampliado, incluindo-se a zona de transição e, quando for o caso, maior representatividade do local onde o laudo foi “suspeito, mas não diagnóstico de adenocarcinoma”. Hoje, não está mais indicada a rebiópsia em casos de neoplasia intraepitelial prostática (NIP), a não ser que seja observada em mais de três fragmentos. Somente a NIP alto grau (grau 2 ou 3) é consignada no laudo.
VIII.1.4 Infiltrado inflamatório
É um achado frequente em biópsias; contudo, não há diferenças morfológicas significativas entre pacientes com e sem infecção evidenciada por cultura de bactérias. Em muitos espécimes prostáticos com inflamação crônica proeminente, organismos não são cultivados; em espécimes prostáticos com culturas positivas, frequentemente não se observa inflamação proeminente no tecido. Em função dessas discrepâncias, Epstein et al. (2001) preconizam que em biópsias não se deve fazer o laudo de prostatite e, sim, infiltrado inflamatório, porque prostatite para o urologista é sinônimo de infecção. Ainda de acordo com esses autores, em biópsias, só deve ser consignado no laudo o infiltrado inflamatório ativo (presença de neutrófilos no estroma) ou inativo, quando este último for intenso e difuso. Neutrófilos vistos somente no lume acinar podem significar apenas urina infectada refluída; assim, isso não deve ser consignado.
VIII.1.5 Graduação histológica (Gleason)
É o sistema de graduação mais usado mundialmente. A graduação no sistema Gleason baseia-se na diferenciação glandular e no padrão de crescimento em relação ao estroma. Nesse sistema, não se consideram as atipias nucleares. De acordo com este sistema, o grau histológico poderá ser de 1 a 5, e a contagem final de 2 a 10. Ao contrário de outros sistemas, considera-se tanto o padrão predominante quanto o padrão secundário. Assim, por exemplo, se o grau histológico de 90% da área examinada for 3 e de 10% for 4, o grau do tecido neoplásico será 3 + 4, o que resultaria em uma contagem final de 7. Caso o grau histológico seja 3 em toda a área examinada, repete-se o número; o grau será 3 + 3 e a contagem final 6.
Em 2005, a International Society of Urological Pathology (ISUP) realizou durante o encontro da United States and Canadian Academy of Pathology (USCAP) em San Antonio, Califórnia, uma reunião de consenso com o intuito de aperfeiçoar o sistema Gleason de graduação histológica (Epstein et al., 2005).
As razões que motivaram a realização dessa reunião de consenso foram:
- Na época da proposta do sistema Gleason, o PSA sérico não tinha sido descoberto; a maioria dos pacientes era diagnosticada em fases avançadas da doença.
- A maioria dos pacientes estudados mostrava doença avançada.
- As biópsias eram realizadas com agulha calibre 14 e dirigidas apenas a nódulos suspeitos ao toque retal.
- Não havia imuno-histoquímica para demonstração de células basais; é possível que muitos casos considerados Gleason 1 + 1 = 2 ou 2 + 2 = 4 correspondessem à adenose.
- O sistema original não avaliou variantes histológicas do adenocarcinoma (mucinoso, ductal, células espumosas e pseudo-hiperplásico), bem como alguns achados peculiares (arranjo glomeruloide e micronódulos colágenos).
Em 2014, foi reconhecido que a revisão do sistema Gleason de graduação de 2005 tinha necessidade de modificações adicionais por várias razões:
- desde 2005, novos trabalhos e dados foram publicados que devem ser considerados;
- para alguns tópicos discutidos em 2005 não houve consenso e ficaram em aberto;
- alguns aspectos de graduação não foram discutidos em 2005; e,
- mudanças na conduta do câncer da próstata levou alguns clínicos a contestar o sistema de graduação existente necessitando uma resposta da comunidade de patologistas.
Para abordar estas questões, a ISUP realizou em novembro de 2014 em Chicago, uma reunião de consenso da qual participaram 67 patologistas de diferentes países além de 18 clínicos de renome na área de câncer da próstata, incluindo urologistas, radioterapeutas e oncologistas. Havia também interesse que as resoluções fossem incluídas na nova edição de classificação de tumores da OMS (Epstein et al., 2016)
Foi consenso na reunião:
- todos os ácinos com arranjo cribriforme devem ser considerados grau 4 de Gleason, independente do tamanho e contorno;
- o arranjo glomeruloide deve ser considerado grau 4;
- propor um novo diagrama esquemático do sistema Gleason de graduação;
- a contagem final 7 de Gleason mostra diferenças prognósticas substanciais considerando a contagem final 3+4=7 ou 4+3=7;
- foi proposto por Epstein, baseado em dados da Johns Hopkins (Pierorazio et al. 2013), um novo agrupamento de graduação em 5 grupos (1 a 5) de acordo com a contagem final de Gleason. Além do valor prognóstico, Epstein argumenta que, em casos de câncer com critérios para acompanhamento vigiado, é mais fácil o paciente considerar a contagem final 6 como de menor risco prognóstico considerando que ela se situa no grupo 1. Em comparação, uma contagem final 6 numa escala que varia de 2 a 10, seria intermediária.
VIII.1.5.1 Graus (padrões) histológicos 1 a 5 de Gleason de acordo com a proposta da reunião de consenso da ISUP em 2014.
Graus 1 e 2. Não há caráter infiltrativo; a neoplasia é bem delimitada em toda a sua extensão sendo diagnosticada pelo desarranjo arquitetural; as margens são precisas e há pouco espaço entre os ácinos neoplásicos que se apresentam, em geral, arredondados ou ovalados bem individualizados e sem caráter infiltrativo no estroma ou fusão entre os mesmos. O grau 2 é semelhante ao grau 1; os ácinos não são tão uniformes, há uma maior distância entre eles e na periferia do nódulo pode haver infiltração mínima. Na prática não se faz uma distinção rigorosa entre os graus 1 e 2. Estes graus de Gleason são vistos em carcinomas de localização na zona de transição. Assim, somente seria diagnosticado em material de RTU para tratamento de HNP ou espécimes cirúrgicos de prostatectomia radical. É muito excepcional que o grau 1 ou 2 de Gleason seja visto em biópsias de agulha as quais amostram a zona periférica. Além disso, a neoplasia é bem delimitada em toda a extensão o que não pode ser analisado numa biópsia de agulha cujo fragmento é muito estreito não podendo, assim, amostrar a lesão na íntegra.
Grau 3. Há nítido caráter infiltrativo e os ácinos, pequenos na grande maioria, são bem individualizados. Este é o grau mais frequente diagnosticado em biópsias de agulha.
Grau 4. Na reunião de consenso da ISUP de 2014 são considerados grau 4 de Gleason: 1) fusão acinar; 2) ácinos mal definidos com lumes pouco evidentes; 3) arranjo cribriforme; e, 4) arranjo glomeruloide. Neste último, o tufo saliente na luz acinar pode ser sólido ou, mais frequentemente, cribriforme. Na reunião de consenso de 2005, o arranjo cribriforme era considerado como grau 3 quando o ácino mostrava contorno regular e não ultrapassava o volume de um ácino normal; na reunião de consenso de 2014 é considerado grau 4 qualquer que seja o tamanho ou contorno acinar.
Grau 5. Arranjo sólido, cordonal ou células isoladas e comedocarcinoma em massas tumorais sólidas, cribriformes ou papilíferas.
VIII.1.5.2 Recomendações para variantes histológicas
- Carcinoma de células em anel de sinete: a presença dos vacúolos não influi na graduação; avaliar apenas a arquitetura.
- Células espumosas: avaliar apenas a arquitetura.
- Adenocarcinoma ductal: grau 4 (variantes papilífera e cribriforme) ou grau 5 (comedocarcinoma).
- Adenocarcinoma mucinoso: pode mostrar grau 3 ou 4.
- Carcinoma de pequenas células: não graduar.
- Com muco focal: ignorar estas áreas e graduar de acordo com a arquitetura predominante.
- Micronódulos colágenos: não considerar para fins de graduação.
- Arranjo glomeruloide: grau 4.
- Adenocarcinoma pseudo-hiperplásico: grau 3
VIII.1.5.3 Recomendações para biópsias de agulha
- Grau terciário. Em biópsias com grau predominante 3, secundário 4 e terciário 5, como se deve graduar? A reunião de consenso recomendou usar o grau terciário quando este for maior que o secundário. Assim, nesse exemplo, a graduação seria 3 + 5 = 8. Outra possibilidade seria consignar o grau terciário em forma de uma nota no laudo; entretanto, a reunião de consenso não recomendou esta conduta, argumentando que os urologistas ignoram notas; todos os nomogramas para conduta, se baseiam em dois números.
- Grau secundário baixo, mas muito limitado. Em um caso em que 98% da extensão for grau 4 e 2% grau 3, como se deve graduar? A reunião de consenso recomendou ignorar grau secundário baixo, que ocupa menos que 5% da área tumoral. Assim, neste exemplo, a graduação seria 4 + 4 = 8.
- Grau secundário alto, mas muito limitado. Em um caso em que 98% da extensão for grau 3 e 2% grau 4, mesmo com grau secundário tão limitado, deve-se graduar como 3 + 4 = 7. Em relação a esta recomendação, não houve consenso para prostatectomias radicais.
- Fragmentos da biópsia com graus diversos. Graduar cada fragmento separadamente ou fornecer um único grau final pela média? A reunião de consenso recomendou graduar cada fragmento separadamente. Somente graduar pela média quando o material estiver fragmentado.
VIII.1.5.4 Recomendações para prostatectomias radicais
- Quando maior que o secundário, consignar o grau terciário apenas em forma de nota.
- A reunião de consenso não recomendou a avaliação da porcentagem dos graus 4 ou 5 em prostatectomias radicais.
- Quando existirem dois nódulos predominantes em uma prostatectomia radical, como graduar? Por exemplo, um nódulo predominante na zona periférica 4 + 4 = 8 e outro predominante na zona de transição 2 + 2 = 4; a reunião de consenso recomendou graduar e relatar ambos no laudo.
VIII.1.6 O laudo “suspeito, mas não diagnóstico de adenocarcinoma”
Em alguns casos, o anatomopatologista não consegue fechar o diagnóstico de adenocarcinoma. Isso decorre de duas causas principais: (1) o foco é muito pequeno, desaparece em cortes seriados ou faltam critérios arquiteturais e/ou citológicos seguros para um diagnóstico de certeza; (2) há diagnósticos diferenciais. Os mais frequentes são: atrofia focal notadamente a variante parcial, ramos menores de ácinos normais e adenose. Quando há dúvida quanto ao diagnóstico definitivo, o laudo é “suspeito, mas não diagnóstico de adenocarcinoma”.
Essa denominação equivale ao termo “proliferação atípica de pequenos ácinos” de alguns autores (ASAP, sigla em inglês) (Iczkowski et al., 1997), o qual a ISUP recomenda não ser empregado porque pode ser interpretado como uma entidade nosológica. O laudo “suspeito, mas não diagnóstico” é apenas uma condição de dúvida diagnóstica que não deve ser superior a 5% dos laudos totais de biópsias prostáticas. Caso isso ocorra, há necessidade de uma reavaliação dos critérios diagnósticos. Na literatura, a frequência do laudo “suspeito, mas não diagnóstico de carcinoma” varia de 2,9 a 7,1% (Young et al., 2000). Mediante esse laudo, indica-se uma segunda biópsia com maior amostragem da área suspeita, que será positiva para carcinoma em 21 a 57,1% dos casos. Recomenda-se que, ao fazer o laudo “suspeito, mas não diagnóstico de adenocarcinoma”, seja anexada uma nota justificando os motivos que não permitiram o diagnóstico conclusivo.
Em focos “suspeitos”, a imuno-histoquímica para detecção de células basais pode auxiliar na elaboração de um diagnóstico definitivo de adenocarcinoma. Entretanto, quando o foco “suspeito” decorre de um diagnóstico diferencial com atrofia focal parcial, adenose ou ramos menores de ácinos normais, a imuno-histoquímica, deve ser interpretada com cautela. Nestas 3 condições, as células basais podem estar espaçadas e, em alguns ácinos, totalmente ausentes. Assim, em focos pequenos (não existe um número mágico para a quantidade de ácinos), a ausência de células basais não exclui que a lesão seja uma das lesões benignas consideradas no diagnóstico diferencial. Isso explica porque, em alguns casos, o diagnóstico de “suspeito, mas não diagnóstico de adenocarcinoma” permanece após uso da imuno-histoquímica – fato pouco entendido pelos urologistas. O uso concomitante de racemase pode auxiliar na elaboração de um diagnóstico definitivo, mas sabe-se que ela também pode ser positiva, em percentual e intensidade variáveis, na atrofia focal parcial, na adenose e em ácinos normais.
VIII.1.7 Invasão perineural
Para alguns autores, este achado em biópsias de agulha tem valor preditivo para extensão extraprostática (Bastacky et al., 1993). Assim, poderia nortear o urologista quanto à preservação do feixe neurovascular na prostatectomia radical. Esse valor preditivo, entretanto, é controverso na literatura (Egan et al., 1997; Billis et al., 2010). Assim, consignar invasão perineural na biópsia de agulha é opcional.
VIII.1.8 Extensão extraprostática
O critério mais seguro para se evidenciar esta extensão é a invasão neoplásica no tecido adiposo, cuja presença é muito rara no parênquima prostático.
VIII.1.9 Estádio T1c com pequeno(s) foco(s) de adenocarcinoma
Com a ampliação do rastreamento para câncer da próstata, um número cada vez maior de homens tem sido diagnosticado no estádio T1c, bem como tendo pequenos focos de carcinoma (não raro único) na biópsia de agulha. Cerca de 30% destes casos também apresentam tumores muito pequenos
(< 0,5 cc) na prostatectomia radical, inclusive podendo haver dificuldade em detectá-los no processamento do espécime cirúrgico (DiGiuseppe et al., 1997).
Epstein et al. (1994) estabeleceram critérios em biópsias de agulha preditivos de carcinoma de baixo risco, isto é, carcinoma com volume mínimo e achados patológicos favoráveis numa eventual prostatectomia radical. Em análise contemporânea desses critérios, o valor preditivo é de 84% (Bastian et al., 2004) (Tabela 1). Quando presentes na biópsia, deve ser consignado no laudo anatomatológico que há critérios para carcinoma da próstata de baixo risco.
Tabela 1 Achados anatomopatológicos e laboratoriais em biópsias de agulha preditivos de carcinoma de baixo risco, de acordo com Epstein.
| Número de fragmentos com carcinoma | Até 2 |
| Extensão tumoral em 1 fragmento | < 50% da área |
| Graduação histológica (Gleason) | Ausência de graus 4 ou 5 |
| Densidade do PSA | ≤ 0,15 |
É preciso notar que carcinoma de baixo risco se refere apenas a uma predição de volume tumoral pequeno e achados patológicos favoráveis numa eventual prostatectomia radical. Não se pode saber, entretanto, se esse tumor terá comportamento biológico latente ou se evoluirá para um carcinoma clínico. É por esta razão que estes pacientes devem ter acompanhamento vigiado que inclui dosagens periódicas de PSA e novas biópsias.
A ressonância magnética multiparamétrica tem sido cada vez mais utilizada no acompanhamento vigiado do câncer de próstata com critérios de baixo risco, bem como, em alguns casos, como o exame inicial de pacientes com suspeita de carcinoma substituindo a biópsia prostática. Os achados na ressonância magnética multiparamétrica são classificados como sendo PI-RADS 1, 2, 3, 4 e 5 sendo 1 e 2 de baixo risco, 3 intermediário e 4 e 5 alto risco. Há também a ressonância magnética biparamétrica aparentemente com os mesmos resultados mas custo financeiro e tempo de realização menores.
Em alguns serviços o acompanhamento vigiado também é oferecido a pacientes com risco intermediário favorável o qual corresponde à contagem final de Gleason 3+4=7 na biópsia mas com grau 4 até 10% da extensão tumoral (Morash et al. 2015) e sem presença de arranjo cribriforme (Keefe et al., 2015).
A existência de carcinomas da próstata latentes tem base epidemiológica, quando é feita uma comparação entre a frequência do carcinoma histológico encontrado em autópsias e a prevalência do carcinoma clínico na população. Para um homem com 50 anos de idade e com expectativa de vida de mais 25 anos, o risco de ter adenocarcinoma histológico é de 42%, e de carcinoma clínico 9,5%. O risco de falecer pelo carcinoma prostático é ainda menor (2,9%) (Scardino et al., 1992). A diferença nessas prevalências é uma forte evidência para a existência de carcinomas da próstata latentes.
VIII.2 Processamento do material de RTU ou prostatectomia aberta
VIII.2.1 RTU
São obtidos pequenos fragmentos alongados de próstata que devem ser pesados. Deve-se examinar cada um dos fragmentos com o intuito de detectar áreas pardacentas e/ou amareladas. Áreas pardacentas podem corresponder a infarto, e amareladas a carcinoma. É recomendável que o anatomopatologista processe seis cápsulas com fragmentos de RTU para material ressecado de até 30 g e uma cápsula para cada 10 g adicionais. O restante do material deve ser guardado como reserva. A presença de NIP na microscopia é uma indicação para processamento do material da reserva, na tentativa de se detectar eventual carcinoma incidental.
VIII.2.2 Prostatectomia aberta (nodulectomia)
Os lobos devem ser separados, medidos e pesados. Cada lobo deve ser seccionado em fatias de 0,5 cm de espessura, obtendo-se um número total proporcional ao tamanho do lobo. A superfície de corte deve ser descrita. Áreas pardacentas e/ou amareladas têm o mesmo significado que os fragmentos de RTU. De cada fatia, deve ser obtido pelo menos um fragmento quadrado (0,3 cm de lado) de cada um dos quadrantes. A finalidade do exame desses fragmentos não é diagnosticar a hiperplasia nodular da próstata (HNP), o que é feito já na macroscopia, mas detectar eventual presença de NIP e/ou carcinoma incidental.
VIII.3 Prostatectomia radical
A confecção e a anexação de cópia do desenho esquemático (Figura 1) ao laudo é altamente recomendável. Esse desenho fornece ao urologista a visualização rápida, prática e panorâmica de todos os achados anatomopatológicos (Billis, 2015).
VIII.3.1 Processamento do espécime cirúrgico
- Medir e pesar a peça cirúrgica.
- Se a peça vier a fresco, fixá-la em formol tamponado durante 24 horas.
- Pintar com tinta nanquim toda a superfície externa da próstata, utilizando pelo menos duas cores para identificação dos lados direito e esquerdo.
- Pincelar a superfície logo após com ácido acético (vinagre), o que ajuda na adesão da tinta nanquim à peça.
- Seccionar transversalmente a glândula em fatias com aproximadamente 0,5 cm de espessura.
- Descrever a área tumoral, quando visualizada. Na maioria das vezes, ela não é identificada.
- Descrever a presença de nódulos hiperplásicos.
- Seccionar cada fatia transversal da glândula em quatro quadrantes.
- Seccionar as vesículas seminais direita (VSD) e esquerda (VSE) em fragmentos transversais, separando-os em porções proximal (P), média (M) e distal (D).
- Seccionar os ductos deferentes, separando-os em porção proximal (corte transversal) e porção distal (corte longitudinal).
- Separar as margens de ressecção vesical (MB) e uretral (apical) (MU) pela dissecção em forma de cone. Os autores têm preferência pela sigla MB para margem cirúrgica vesical, a fim de evitar confusão entre as letras V (vesical) e U (uretral), quando estas são escritas à mão.
- Em reunião de consenso da ISUP foi estabelecido que processamento parcial do espécime de prostatectomia radical também pode ser feito mas devidamente informado e descrito no laudo.
VIII.3.2 Fragmentos para microscopia
- Fragmentos obtidos por cortes transversais representativos das porções proximal (P), média (M) e distal (D) de ambas as vesículas seminais.
- Um fragmento (corte transversal) da porção proximal e um fragmento (corte longitudinal) da porção distal de ambos os ductos deferentes; são opcionais, uma vez que o comprometimento do ducto deferente só ocorre em casos com invasão de vesícula seminal.
- Fragmentos longitudinais dos cones das margens de ressecção vesical e uretral, obtendo-se preferencialmente oito fragmentos de cada uma das margens.
- Um fragmento representando toda a extensão de cada um dos quadrantes das fatias transversais. Todos os quadrantes são numerados à esquerda e à direita, de baixo para cima. Se os cortes transversais fornecerem quatro fatias, tem-se 16 quadrantes e, consequentemente, 16 fragmentos para o exame microscópico. A glândula prostática deve ser inteiramente embebida em parafina para exame histológico, aceitando-se o embebimento parcial; nesse caso, é importante que fique documentada a metodologia de amostragem utilizada (Osunkoya, 2012).
- Utilizando-se o método semiquantitativo proposto de contagem de pontos, pode-se fazer uma avaliação da extensão tumoral. Desenhado em uma folha de papel, cada quadrante contém oito pontos equidistantes. À medida que os quadrantes são examinados no microscópio, a área ocupada pelo tumor é desenhada proporcionalmente no quadrante correspondente na folha de papel. A análise da distribuição dos pontos positivos em 109 prostatectomias radicais permitiu separar os tumores em cinco grupos de acordo com a extensão: muito limitado (≤ 10 pontos positivos); limitado (11 a 19 pontos positivos); moderadamente extenso (20 a 35 pontos positivos); extenso (36 a 69 pontos positivos); e muito extenso (≥ 70 pontos positivos) (Billis et al., 2003). É controverso, na literatura, se a extensão tumoral é um fator preditivo independente de progressão pós-prostatectomia radical (Epstein, 2011). Assim, uma avaliação quantitativa de extensão tumoral seria opcional. Aconselha-se, entretanto, que seja fornecida pelo menos uma avaliação visual da extensão tumoral.
IX. Bibliografia
AJCC Cancer Staging Manual, Amin, MB (Ed.), 8th edition, Springer, 2017.
Bastacky SI, Walsh PC, Epstein JI. Relation between perineural tumor invasion on needle biopsy and radical prostatectomy capsular penetration in clinical stage B adenocarcinoma of the prostate. Am J Surg Pathol 1993; 17:336-41.
Bastian PJ, Mangold LA, Epstein JI, Partin AW. Characteristics of insignificant clinical T1c prostate tumors. A contemporary analysis. Cancer 2004; 101:2001-5.
Billis A. Patologia cirúrgica da próstata, 4a ed., Campinas: Novo Enfoc Impressão Digital, 2015.
Billis A, Freitas LLL, Magna LA, Samara AB, Ferreira U. Prostate cancer with bladder neck involvement: Pathologic findings with application of a new practical method for tumor extent evaluation and recurrence-free survival after radical prostatectomy. Int Urol Nephrol 2004; 36:363-8.
Billis A, Magna LA, Ferreira U. Correlation between tumor extent in radical prostatectomies and preoperative PSA, histological grade, surgical margins, and extraprostatic extension: application of a new practical method for tumor extent evaluation. Int Braz J Urol 2003; 29:113-20.
Billis A, Quintal MM, Meirelles L, Freitas LLL, Magna LA, Ferreira U. Does tumor extent on needle prostatic biopsies influence the value of perineural invasion to predict pathologic stage >T2 in radical prostatectomies? Int Braz J Urol 2010; 36:439-49.
DiGiuseppe JA, Sauvageot J, Epstein JI. Increasing incidence of minimal residual cancer in radical prostatectomy specimens. Am J Surg Pathol 1997; 21:174-8.
Egan AJM, Bostwick DG. Prediction of extraprostatic extension of prostate cancer based on needle biopsy findings: perineural invasion lacks significance on multivariate analysis. Am J Surg Pathol 1997; 21:1496-500.
Epstein JI, Allsbrook Jr WC, Amin MB, Egevad LL; The ISUP Grading Committee. The 2005 International Society of Urological Pathology (ISUP) consensus conference on Gleason grading of prostatic carcinoma. Am J Surg Pathol 2005; 29:1228-42.
Epstein JI, Potter SR. The pathological interpretation and significance of prostate needle biopsy findings: Implications and current controversies. J Urol 2001; 166:402-10.
Epstein JI, Walsh PC, Carmichael M, Brendler CB. Pathologic and clinical findings to predict tumor extent of nonpalpable (stage T1c) prostate cancer. Jama 1994; 271:368-74.
Epstein JI. Prognostic significance of tumor volume in radical prostatectomy and needle biopsy specimens. J Urol 2011; 186:790-7.
Epstein JI, Egevad L, Amin MB, Delahunt B, Srigley JR, Humphrey PA; Grading Committe. The 2014 International Society of Urological Pathology (ISUP) consensus conference on Gleason grading of prostatic carcinoma: Definition of grading patterns and proposal for a new grading system. Am J Surg Pathol 2016;40:244-52.
Iczkowski KA, MacLennan GT, Bostwick DG. Atypical small acinar proliferation suspicious for malignancy in prostate needle biopsies: clinical significance in 33 cases. Am J Surg Pathol 1997; 21:1489-95.
Keefe DT, Schieda N, El Hallani S, Breau RH, Morash C, Robertson SJ, Mai KT, Beianger EC, Flood TA. Cribriform morphology predicts upstaging after radical prostatectomy in patients with Gleason score 3+4=7 prostate cancer at transrectal ultrasound (TRUS)-guided needle biopsy. Virchows Arch 2015;467:437-42.
Morash C, Tey R, Agbassi C, Klotz L, McGowan T, Srigley J, Evans A. Active surveillance for the management of localized prostate cancer: Guidelines recommendations. Can Urol Assoc 2015;9:171-8.
Pierorazio PM, Walsh PC, Partin AW, Epstein JI. Prognostic Gleason grade grouping: data based on the modified Gleason scoring system. IBJU Int 2013;111:753-60.
Osunkoya AO. Update on prostate pathology. Pathology 2012;44:391-406.
Scardino PT, Weaver R, Hudson MA. Early detection of prostate cancer. Hum Pathol 1992; 23:211-22.
Young RH, Srigley JR, Amin MB, Ulbright TM, Cubilla AL (eds.). Tumors of the prostate gland, seminal vesicles, male urethra, and penis. In: Atlas of tumor pathology. 3. Series, Fascicle 28. Washington: Armed Forces Institute of Pathology, 2000.
Voltar para a página inicial do manual