Simone Marcia dos Santos Machado
Códigos de topografia
C25 Neoplasia maligna do pâncreas
C25.0 Neoplasia maligna da cabeça do pâncreas
C25.1 Neoplasia maligna do corpo do pâncreas
C25.2 Neoplasia maligna da cauda do pâncreas
C25.3 Neoplasia maligna do canal pancreático
C25.4 Neoplasia maligna do pâncreas endócrino
C25.7 Neoplasia maligna de outras partes do pâncreas
C25.8 Neoplasia maligna do pâncreas com lesão invasiva
C25.9 Neoplasia maligna do pâncreas, não especificado
I. Identificação e resumo clínico
II. Dados clínicos relevantes
- Massa palpável
- Diabete melito
- Icterícia
- Úlceras digestivas
- Perda de peso
- Antecedente de pancreatite
- Diarreia
- Dosagem sérica de Ca19.9 pré-operatório
- Dosagem sérica de CEA pré-operatório
- Peptídeos séricos
- Outros tumores endócrinos
III. Procedimento cirúrgico
- Biópsia incisional
- Biópsia excisional (enucleação)
- Duodenopancreatectomia (cirurgia de Whipple)
- Pancreatectomia distal (cauda do pâncreas + esplenectomia)
- Pancreatectomia total (pâncreas + baço)
- Gastroduodenopancreatectomia total (pâncreas + segmento gástrico + baço)
- Outro (especificar) ___________
- Não especificado
IV. Exame macroscópico
IV.1 Órgãos presentes na peça cirúrgica
Pâncreas
- Total
- Segmento ____ Peso ____ kg
- Extensão ___ x ___ x ___ cm
Papila
- Alterações ______________
Ducto biliar comum
- Extensão ____ cm
- Parede ____ cm
- Calibre ____ cm
- Cálculo____
Ducto pancreático
- Extensão ____ cm
- Parede ____ cm
- Calibre ____ cm
- Cálculo____
Ducto pancreático acessório
- Extensão ____ cm
- Parede ____ cm
- Calibre ____ cm
- Cálculo____
Duodeno
- Extensão de segmento _____ cm
- Mucosa
- Invasão pelo tumor
- Sim
- Não
Estômago
- Extensão de segmento _____ cm
- Mucosa
- Invasão pelo tumor
- Sim
- Não
Baço
- Medida ___ x ___ x ___ cm
- Peso ______ g
- Aspecto ____________
- Invasão pelo tumor
- Sim
- Não
IV.2 Lesão
- Sólida
- Cística unilocular
- Cística multilocular
- Intraductal
- Encapsulada
- Não encapsulada
Forma ___________
Tamanho tumoral ___ x ___ x ___ cm
Cor ________
Sítio tumoral
- Cabeça do pâncreas
- Processo uncinado
- Corpo do pâncreas
- Cauda do pâncreas
- Outros (especificar) _______________
- Não pode ser determinado
- Não especificado
Em caso de invasão de ductos
- Plana
- Infiltrativa
- Ulcerada
- Papilar
Extensão por continuidade para ______________ (pode incluir invasão de tecido adiposo peripancreático, peritônio incluindo mesocólon e epíploon, sistema biliar extrapancreático e/ou duodeno incluindo a ampola de Vater, estômago, baço, adrenal esquerda).
Outras lesões
- Atrofia
- Fibrose
- Necrose
- Cistificação
- Dilatação ductal
IV.3 Margens cirúrgicas
- Não avaliáveis
- Margens livres de envolvimento neoplásico (carcinoma invasivo e neoplasia intraepitelial de alto grau)
Distância do tumor à margem mais próxima (milímetros ou centímetros) ______ mm ou cm.
- Especificar a margem mais próxima (se possível) ____________
- Margens envolvidas pela neoplasia
- Margem do parênquima pancreático proximal
- Margem do parênquima pancreático distal
- Margem do processo uncinado (retroperitonial/artéria mesentérica superior)
- Margem radial do parênquima pancreático
- Margem do ducto biliar
- Margem proximal (gástrica ou duodenal)
- Margem distal (duodenal ou jejunal)
- Margem do processo uncinado (retroperitoneal)
Nota 1: A superfície não revestida pelo peritônio do processo uncinado constitui a margem retroperitoneal da duodenopancreatectomia e deve ser pintada. Cortes que incluam o tumor e esta margem devem ser submetidos à análise histológica.
Nota 2: Quando se tratar de neoplasia intraductal, a margem de ressecção distal, a margem do ducto biliar comum (Whipple) ou a margem de ressecção proximal (pancreatectomia distal) são as mais importantes e devem ser completamente amostradas.
IV.4 Linfonodos (Figura 1)
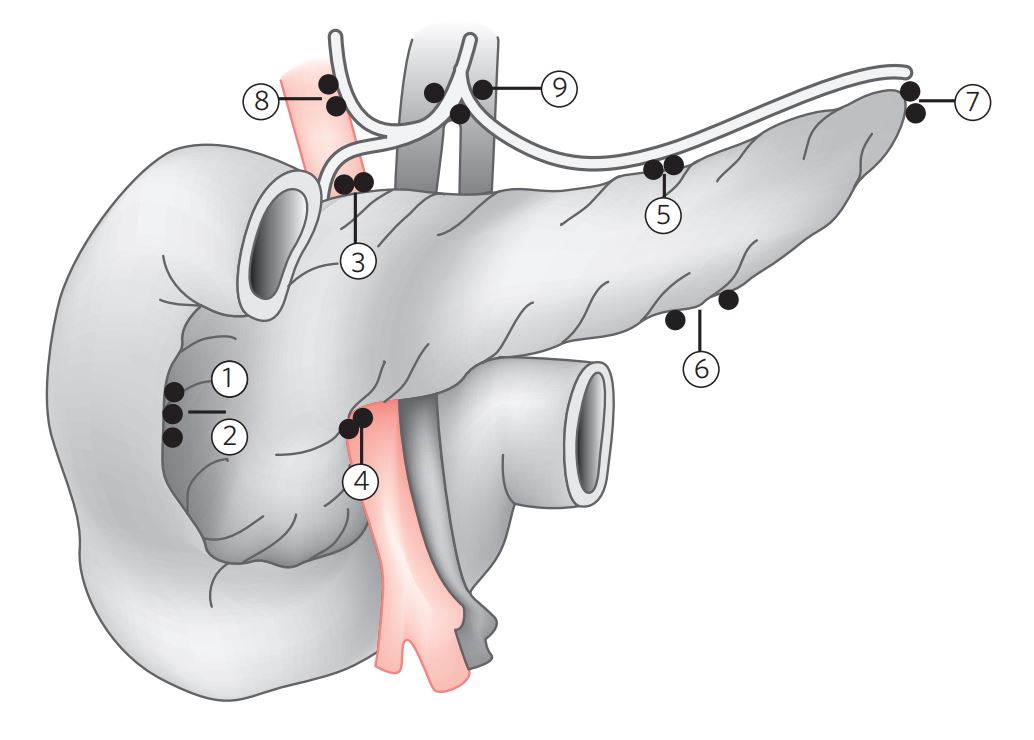
Figura 1 Linfonodos regionais do pâncreas.
1 e 2: linfonodos pancreaticoduodenais anteriores e posteriores; 3 e 4: linfonodos da cabeça, respectivamente superiores e inferiores; 5 e 6: linfonodos do corpo, respectivamente superiores e inferiores; 7: linfonodos esplênicos; 8 e 9: linfonodos porta-hepáticos e celíacos, respectivamente.
Linfonodos regionais para neoplasia pancreática incluem linfonodos ao longo do ducto biliar comum, artéria hepática, veia porta, pilóricos, carcada pancreatoduodenal anterior e posterior, veia mesentérica superior, artéria mesentérica superior. Linfonodos regionais para corpo e cauda pancreática incluem linfonodos da artéria hepática comum, tronco celíaco, artéria esplênica e hilo esplênico.
Nota 1: Divisão anatômica de linfonodos não é necessária, mas linfonodos encaminhados separadamente devem ser laudados individualmente.
Nota 2: Metástase nodal é um fator independente de prognóstico adverso. É recomendada a avaliação de pelo menos 12 linfonodos para ressecções de Whiplle.
Nota 3: Envolvimento de outros grupos de linfonodos é considerado metástase à distância.
V. Exame microscópico
V.1 Tipo histológico
(Classificação histológica dos tumores do pâncreas exócrino – OMS, 2010)
V.1.1 Pâncreas exócrino
Tumores benignos
- Cistadenoma de células acinares
- Cistadenoma seroso
Lesões pré-malignas
- Neoplasia intraepitelial pancreática, grau 3 (PanIN-3)
- Neoplasia mucinosa papilífera intraductal com displasia de baixo grau ou de grau intermediário
- Neoplasia mucinosa papilífera intraductal com displasia de alto grau
- Neoplasia tubulopapilífera intraductal
- Neoplasia cística mucinosa com displasia de baixo grau ou de grau intermediário
- Neoplasia cística mucinosa com displasia de alto grau
Tumores malignos
- Adenocarcinoma ductal
- Carcinoma adenoescamoso
- Carcinoma coloide (carcinoma mucinoso não cístico)
- Carcinoma de células em anel de sinete
- Carcinoma adenoescamoso
- Neoplasia mucinosa papilar intraductal associada a carcinoma invasivo
- Neoplasia tubulopapilar intraductal associada a carcinoma invasivo
- Neoplasia cística mucinosa associada a carcinoma invasivo
- Carcinoma neuroendócrino de grandes células
- Carcinoma neuroendócrino de pequenas células
- Carcinoma neuroendócrino (pouco diferenciado)
- Carcinoma indiferenciado (anaplásico)
- Carcinoma indiferenciado com células gigantes tipo osteoclásticas
- Carcinoma de células acinares
- Cistoadenocarcinoma de células acinares
- Cistoadenocarcinoma seroso
- Carcinoma misto ductal-acinar
- Carcinoma misto ductal-neuoendócrino
- Carcinoma misto acinar-neuroendócrino
- Carcinoma misto acinar-neuroendócrino-ductal carcinoma
- Neoplasia sólida pseudopapilar
- Carcinoma hepatoide
- Carcinoma medular
- Pancreatoblastoma
- Outros tipos histológicos não listados (especificar) ________________
V.1.2 Pâncreas endócrino
- Microadenoma neuroendócrino pancreático (< 0,5 cm e não funcionante )
- Tumor neuroendócrino (NET) (não funcionante)
- Tumor neuroendócrino bem diferenciado, grau 1
- Tumor neuroendócrino bem diferenciado, grau 2
- Tumor neuroendócrino bem diferenciado, grau 3
- Carcinoma neuroendócrino (NEC)
- Carcinoma neuroendócrino de grandes células (LCNEC)
- Carcinoma neuroendócrino de pequenas células (SCUC)
- Tumor neuroendócrino pancreático funcionante
- Tumor neuroendócrino produtor de serotonina
- Gastrinoma
- Glucagonoma
- Insulinoma
- Somatostatinoma
- Tumor neuroendócrino produtor do peptídeo vasoativo intestinal (VIPoma)
- Teratoma maduro
- Tumores mesenquimais
- Linfomas
V.1 Grau histológico
V.2.1 Adenocarcinoma ductal
- Não aplicável
- Grau 1 – Bem diferenciado
- Grau 2 – Moderadamente diferenciado
- Grau 3 – Pouco diferenciado
- Grau 4 – Indiferenciado
V.2.2 Tumores neuroendócrinos
- Não aplicável
- Tumor neuroendócrino bem diferenciado (NET); grau 1
- Tumor neuroendócrino bem diferenciado (NET); grau 2
- Tumor neuroendócrino bem diferenciado (NET); grau 3
- Carcinoma neuroendócrino pouco diferenciado (NEC); grau 3
Nota: A classificação atual dos tumores neuroendócrinos do pâncreas da OMS (2017) é baseada no número de mitoses e no índice de proliferação celular avaliado pela imunocoloração para o antígeno Ki-67.
Tabela 1 Classificação dos tumores neuroendócrinos do pâncreas (OMS, 2017).
| Classificação | Grau (OMS) | Características |
| Tumor neuroendócrino bem diferenciado, grau 1 | G1 | < 2 mitoses/10 CGA; índice de proliferação celular pelo Ki-67 < 3% |
| Tumor neuroendócrino bem diferenciado, grau 2 | G2 | 2 a 20 mitoses/10 CGA; índice de proliferação celular pelo Ki-67 de 3 a 20% |
| Tumor neuroendócrino bem diferenciado, grau 3 | G3 | > 20 mitoses/10 CGA; índice de proliferação celular pelo Ki-67 > 20% |
| Carcinoma neuroendócrino pouco diferenciado, grau 3 | G3 | > 20 mitoses/10 CGA; índice de proliferação celular pelo Ki-67 > 20% |
V.3 Taxa de mitose (para tumores neuroendócrinos)
- Não aplicável
- < 2 mitoses/10 campos de grande aumento (CGA) ou 2mm²
Especificar quantidade de mitoses por CGA _________
- ≥ 2 a 20 mitoses/10 CGA ou 2 mm²
Especificar quantidade de mitoses por CGA _________
- > 20 mitoses/10 CGA ou 2 mm²
Especificar quantidade de mitoses por CGA _________
Nota: Tumores neuroendócrinos com um ki67> 20% são divididos em dois grupos pela OMS 2017:
- Tumor neuroendócrino bem diferenciado com alta taxa mitótica / ki67 – geralmente tem ki67 40%
- Carcinoma neuroendócrino pouco diferenciado (SCUC.LCNEC) – geralmente tem um ki67 70%.
- Tem sido recomendada a contagem de no mínimo 500 células tumorais em áreas de maior densidade celular (“hot spot”).
V.4 Extensão microscópica do tumor
- Restrito ao ducto (carcinoma in situ)
- Tumor confinado ao pâncreas
- Invasão da ampola de Vater ou esfíncter de Oddi
- Extensão para o ducto biliar comum
- Invasão da parede duodenal
- Invasão de tecido adiposo peripancreático
- Invasão de órgãos ou estruturas adjacentes (especificar)
V.5 Invasão linfovascular
- Não identificada
- Presente
- Não pode ser determinada
V.6 Invasão perineural
- Não identificada
- Presente
- Não pode ser determinada
V.7 Margens cirúrgicas
- Comprometida(s) pelo componente invasivo; especificar a margem (quando possível) ______________
- Livres de neoplasia invasiva, distando a mais próxima ____ cm do componente invasivo
- Presença de carcinoma in situ
- Na margem do ducto biliar comum
- Na margem do parênquima pancreático
- Ausência de carcinoma in situ
V.8 Achados morfológicos adicionais
- Pancreatite (aguda, crônica)
- Neoplasia intraepitelial pancreática (maior grau: PanIN* _____ )
- Hiperplasia de ilhotas
- Atrofia de ácinos
- Fibrose
- Calcificações
- Outros (especificar) ___________
* PanIN – neoplasia intraepitelial pancreática são lesões não invasivas frequentemente encontradas no parênquima adjacente ao adenocarcinoma ductal. O consenso mais recente recomenda o esquema de graduação em dois graus:
PanIN, baixo grau: compreende PanIN 1A, PanIN 1B e PanIN 2.
PanIN, alto grau: compreende PanIN 3 (corresponde a carcinoma in situ).
V.9 Linfonodos regionais
- Ausência de metástase no total de _____ linfonodos examinados
- Presença de metástase em ____ do total de ____ linfonodos examinados
V.10 Estudos complementares
Tabela 2 Sumário de marcadores úteis no diagnóstico das neoplasias epiteliais pancreáticas
| Anticorpo | DADC | ACC | P-NET | SPT | PB |
| CK7 | – ou + | + ou – | + ou – | ||
| CK19 | – ou + | – ou + | + ou – | ||
| MESOTELINA | + ou – | ||||
| S100P | + ou – | ||||
| MASPINA | + ou – | ||||
| GLYPICAN-3 | + ou – | ND | |||
| BETACATENINA | M | M ou N | M | N e M | N e C, ou M+ |
| E-CADERINA | – ou + | ||||
| CROMOGRANINA | – ou + | ||||
| CD10 | – ou + | ||||
| IMP3 | + ou – | – ou + | |||
| TRIPSINA | + |
Abreviações: +, geralmente mais de 75% dos casos são positivos. -, menos de 5% dos casos são positivos. + ou -, geralmente mais de 50% dos casos são positivos. – ou +, geralmente menos de 50% dos casos são positivos. ACC, carcinoma de acinares. DADC, adenocarcinoma ductal. P-NET, tumor neuroendócrino pancreático, SPT, tumor sólido pseudopapilar. PB, pancreatoblastoma. M, marcação de membrana. N, marcação nuclear. C, marcação citoplasmática. ND, sem dados.
Imuno-histoquímica (para tumores neuroendócrinos)
*Índice de proliferação celular pelo Ki-67 (especificar) ___________
- ≤ 2%
- 3 a 20%
- > 20%
Peptídios hormonais
- Gastrina
- Insulina
- Glucagon
- VIPoma
- Somatostatina
Nota: Não é necessária a realização de rotina do estudo imuno-histoquímico para pesquisa de peptídios hormonais em tumores neuroendócrinos do pâncreas. O diagnóstico de tumor funcionante ou não é baseado na presença ou ausência de síndromes endócrinas ou sintomas clínicos. Tumores não funcionantes podem expressar um ou mais peptídios ao exame imuno-histoquímico, porém, sem repercussão clínica.
VI. Diagnóstico final (exemplo)
Adenocarcinoma ductal, pouco diferenciado, grau 3, com 5,0 cm de extensão, na cabeça do pâncreas. Neoplasia intraepitelial pancreática grau 3 (PanIN-3) em epitélio ductal do parênquima adjacente. Presença de infiltração de vasos linfáticos e de feixes nervosos intrapancreáticos. Ausência de infiltração direta de tecidos e órgãos vizinhos. Margens cirúrgicas livres. Metástase em 3 do total de 20 linfonodos regionais examinados.
Estadiamento patológico: pT3N1; estádio IIB (AJCC, 8ªed).
VII. Comentários
VII.1 Classificação TNM dos tumores de pâncreas, AJCC 8ª edição
T – Tumor primário (pT)
- pTX – Tumor primário não avaliável
- pT0 – Sem evidência de lesão primária
- pTis – Carcinoma in situ (inclui PanIN-3, neoplasia mucinosa papilar intraductal com displasia de alto grau, neoplasia tubulopapilar intraductal com displasia de alto grau e neoplasia cística mucinosa com displasia de alto grau).
- pT1 – Tumor ≤ 2 cm na maior dimensão
- pT1a – Tumor ≤ 0,5 cm na maior dimensão
- pT1b – Tumor > 0,5 cm e <1 cm na maior dimensão
- pT1c – Tumor 1-2 cm na maior dimensão
- pT2 – Tumor > 2 cm e ≤ 4 cm na maior dimensão
- pT3 – Tumor > 4 cm na maior dimensão
- pT4 – O tumor invade o tronco/plexo celíaco ou a artéria mesentérica superior e/ou artéria hepática comum.
N – Linfonodos regionais
- pNX – Linfonodos regionais não avaliáveis
- pN0 – Sem metástases em linfonodos regionais
- pN1 – Metástases em um a três linfonodo(s) regional(is)
- pN2 – Metástases em quatro ou mais linfonodos regionais
- pN3 – Metástases em um a três linfonodo(s) regional(is)
M – Metástase a distância
- M1 – Metástase a distância Especificar sítio(s), se conhecido: ____________________
VII.2 Estadiamento (AJCC, 8ª edição)
Tabela 3 Estadiamento prognóstico das neoplasias do pâncreas
| Estádio | T | N | M |
| 0 | Tis | N0 | M0 |
| IA | T1 | N0 | M0 |
| IB | T2 | N0 | M0 |
| IIA | T3 | N0 | M0 |
| IIB | T1, T2, T3 | N1 | M0 |
| III | T1, T2, T3
T4 |
N2
Qualquer N |
M0
M0 |
| IV | Qualquer T | Qualquer N | M1 |
VII.3 Descritores do TNM
Para identificação de casos especiais da classificação TNM ou pTNM, o sufixo ¨m¨ e os prefixos “y”, “r” e “a” são usados. Embora eles não afetem o estadiamento, eles indicam casos que necessitam análise separada.
“m” sufixo indica a múltiplos tumores primários em um único sítio e é reportado em parênteses: pT(m)NM.
“y” prefixo indica casos em que a classificação é feita durante ou após terapia multimodal inicial (quimioterapia neoadjuvante, radioterapia ou ambos quimio radioterapia): ypTNM.
“r” prefixo indica tumor recorrente quando identificado após um intervalo livre de doença: rpTNM.
“a” prefixo indica que o estágio foi determinado em autópsia: apTNM.
VII.4 Invasão vascular
De acordo com a convenção AJCC/UICC, invasão vascular (linfática ou venosa) não afeta a categoria T, indicando extensão tumoral local.
VIII. Considerações gerais
Carcinomas exócrinos representam mais de 90% dos tumores malignos do pâncreas.
A amostragem para o exame histológico deve incluir: (1) fragmentos da neoplasia, incluindo a interface do tumor com os tecidos adjacentes (parênquima pancreático não neoplásico, ductos, ampola de Vater, mucosa duodenal e tecidos moles); (2) margens (já especificadas); (3) ampola de Vater; (4) parênquima pancreático adjacente, outras lesões; (5) todos os linfonodos regionais (no mínimo isolar 12 linfonodos); (6) fragmentos dos outros órgãos presentes na peça.
As lesões císticas menores que 5 cm devem ser totalmente incluídas. Quando maiores que 5 cm, deve-se incluir um fragmento por centímetro, amostrando áreas irregulares ou nodulares.
Adenocarcinoma ductal pancreático é a neoplasia maligna primária mais comum, correspondendo à cerca de 80% dos tumores malignos pancreáticos. Tabagismo é o principal fator de risco da doença. Outros fatores de risco ainda não bem estabelecidos incluem pancreatite crônica e diabetes. Cerca de 60-70% dos adenocarcinomas ductais estão localizados na cabeça pancreática, 30% no corpo e cauda e 5% envolve a totalidade do órgão. Doença multifocal também já foi descrita, assim como tumores sincrônicos e metacrônicos.
Graduação dos adenocarcinomas ductais:
- Grau 1: bem diferenciado (> 95% do tumor é composto por glândulas).
• Grau 2: moderadamente diferenciado (50 a 95% é composto por glândulas).
• Grau 3: pouco diferenciado (< 50% do tumor é composto por glândulas).
• Grau 4: indiferenciado.
Nos casos de carcinomas pancreáticos tratados com terapia neoadjuvante pré-operatória, devem ser reportados os efeitos do tratamento da seguinte forma:
- Grau 0: resposta completa, sem neoplasia residual.
• Grau 1: resposta moderada, pequenos agrupamentos de células neoplásicas.
• Grau 2: resposta mínima, neoplasia residual em meio a fibrose.
• Grau 3: sem resposta ao tratamento, extensa neoplasia residual.
Para os carcinomas neuroendócrinos pouco diferenciados (de alto grau) (NEC; grau 3), deve ser utilizado o protocolo dos demais carcinomas de pâncreas.
Os tumores neuroendócrinos do pâncreas são frequentemente multifocais. Por isso, o exame macroscópico detalhado com cortes com intervalos de 3 a 5 mm é necessário para se detectar pequenas lesões no parênquima adjacente.
O sistema de estadiamento TNM dos carcinomas do pâncreas exócrino é aplicado também aos carcinomas neuroendócrinos pancreáticos.
Para tumores neuroendócrinos bem diferenciados (NET) considerar o sistema de estadiamento TNM do protocolo de pâncreas endócrino.
Para tumores ampulares considerar o protocolo TNM para ampola de Vater.
Para linfomas considerar o protocolo específico para linfomas Hodgkin ou não-Hodgkin.
Para sarcomas considerar o protocolo de estadiamento para tumores de partes moles.
IX.Bibliografia
Adsay NV, Basturk O, Altinel D, Khanani F, Coban I, Weaver DW et al. The number of lymph nodes identified in a simple pancreatoduodenectomy specimen: comparison of conventional vs orange-peeling approach in pathologic assessment. Mod Pathol 2009; 22(1):107-12.
Amin MB, Edge SB, Byrd DR, Compton CC, Fritz AG, Greene FL, Trotti A (eds.). AJCC cancer staging handbook. 8. ed. New York: Springer, 2017.
Bosman FT, Carneiro F, Hruban RH, Theise ND (eds.). WHO classification of tumours of the digestive system. Geneva: WHO, 2010.
CAP Templates – © 2017 College of American Pathologists (CAP)
https://documents.cap.org/protocols/cp-pancreas-endocrine-17protocol-4001.pdf
CAP Templates – © 2017 College of American Pathologists (CAP)
https://documents.cap.org/protocols/cp-gihepatobiliary-pancreas-exocrine-17protocol-4001.pdf
Campbell F, Verbeke CS. Pathology of the pancreas. A practical approauch. Springer-Verlag London 2013.
D’Onofrio M, Capelli P, Pederzoli P. Imaging and Pathology of Pancreatic Neoplasias. Springer-Verlag Italia 2015.
Fan Lin, MD, PhD; Zongming Eric Chen, MD, PhD; Hanlin L. Wang, MD, PhD. Utility of Immunohistochemistry in Pancreatic Tract. Arch Pathol Lab Med—Vol 139, January 2015
Hruban RH, Pitman MB, Klimstra DS. Tumors of the pancreas. 4. series, 6. ed. Washington: Armed Forces Institute of Pathology, 2007.
Ito H, Abramson M, Ito K, Swanson E, Cho N, Ruan DT et al. Surgery and staging of pancreatic neuroendocrine tumors: a 14-year experience. J Gastrointest Surg 2010; 14(5):891-8.
Klimstra DS, Modlin IR, Coppola D, Lloyd RV, Suster S. The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems. Pancreas 2010; 39(6):707-12.
Lloyd: WHO Classification of Tumours of Endocrine Organs, 4th Edition, 2017:
Pathology Outlines https://www.pathologyoutlines.com/topic/pancreaspen.html
Patology Outlines https://www.pathologyoutlines.com/pancreas.html
Sohn TA, Yeo CJ, Cameron JL, Koniaris L, Kaushal S, Abrams RA et al: Resected adenocarcinoma of the pancreas -616 patients: results, outcomes, and prognostic indicators. J Gastrointest Surg 2000; 4(6):567-79.
Washington K, Berline J, Branton P et al. Protocol for the examination of specimens from patients with carcinoma of the exocrine pancreas. In: Amin MB et al (eds.). Reporting on cancer specimens: case summaries and background documentation. Northfield: College of American Pathologists, 2011.
Voltar para a página inicial do manual
