Eliane Maria Ingrid Amstalden, Ricardo Karam Kalil
Códigos de topografia
C40-41 Neoplasias malignas dos ossos e das cartilagens articulares
C41 Neoplasias malignas dos ossos e das cartilagens articulares de outras localizações e localizações não especificadas
C41.0 Neoplasias malignas dos ossos do crânio e da face
C41.2 Neoplasias malignas dos ossos da coluna vertebral
C41.4 Neoplasias malignas dos ossos pélvicos, sacro, cóccix e das cartilagens articulares
I. Identificação e resumo clínico
II. Dados clínicos relevantes
Idade __________________________ Sexo ___________________________
Tumor: localização/tempo de evolução/progressão ______________________
Sintomas associados: dor; febre; perda de peso/outros ___________________
Doença pregressa: osteocondromatose/condromatose/displasia fibrosa/outras____________________________________________________
Exame físico: deformidades/tumoração/outros ___________
Exames laboratoriais: sangue/urina/outros ___________
Tratamentos prévios: radioterapia/quimioterapia/cirurgias/outros ___________
III. Achados radiológicos
Osso envolvido ___________
Tamanho da lesão ___________
Lesões ósseas associadas (especificar) ___________
Localização da lesão
□ Epífise □ Mista □ Superfície
□ Metáfise □ Central (medular) □ Parosteal
□ Diáfise □ Cortical □ Periosteal
Envolvimento da cartilagem de crescimento
- Presente
- Ausente
Contorno e margem da lesão
□ Bem definida □ Com áreas de indefinição □ Moteada/”roído de traça”
□ Sem esclerose □ Mal definida □ Permeativa
□ Com esclerose □ Geográfica
Mineralização da matriz
- Ausente
- Presente
- Padrão ósseo
- Padrão cartilaginoso
- Outro (especificar) _____________
Rotura de cortical
- Ausente
- Presente
Reação perióstica
- Ausente
- Presente
- Contínua
- Interrompida
Padrão
□ Insuflante □ Capas múltiplas (“casca de cebola”) □ Sólido
□ Sólido □ Espiculado ou “em raios de sol” □ Vazio
□ Lamelar único □ Ângulo/triângulo de Codman
Comprometimento do espaço articular
- Ausente
- Presente
Comprometimento dos tecidos moles adjacentes
- Ausente
- Presente
Multifocalidade da lesão
- Ausente
- Presente
Nota: Recomenda-se que as imagens acompanhem o pedido anatomopatológico. Quando isso não for possível, sugere-se colocar um adendo no final do laudo sobre a necessidade de correlação dos achados morfológicos com os dados clínicos e de imagem.
IV. Procedimento cirúrgico – biópsia
- Por agulha
- A céu aberto
- Ressecção intralesional/curetagem
- Ressecção parcial/marginal
- Ressecção ampla
- Ressecção radical/amputação
- Desarticulação
- Hemipelvectomia
- Outro (especificar) __________________
V. Exame macroscópico
É recomendável receber o material a fresco para a eventual obtenção de amostras para estudos especiais. Não congelar a peça cirúrgica para evitar artefatos por formação de cristais.
V.1 Superfície externa
- Identificar e medir: osso, segmento ósseo ou fragmentos ósseos irregulares
• Descrever os tecidos que recobrem ou acompanham (músculo, tecido adiposo, pele). - Descrever alterações superficiais (abaulamento, deformidades, fratura, etc.)
V.2 Superfície de corte
- Localização em planos longitudinal e transversal
• Extensão intraóssea e infiltração com ou sem rotura de cortical e invasão das partes moles, incluindo articulações. - Reações periósticas
- Medidas da lesão (incluindo, quando houver, a invasão das partes moles)
• Distância entre o tumor e a margem de ressecção mais próxima. - Aspecto da lesão (forma, consistência, coloração)
Em se tratando de lesão suspeita de osteoma osteoide, o reconhecimento da presença do nidus é importante e pode ser observada por transiluminação, seguida da secção, que deve ser feita sempre no sentido da superfície da região
V.3 Secção
- Exames de imagem pré-operatórios ou do espécime cirúrgico são extremamente úteis para planejar a dissecção, ajudam a localizar o tumor na peça e a identificar áreas de extensão da neoplasia para partes moles. Também colaboram na orientação do melhor plano de dissecção e na identificação de áreas de maior interesse, como lesão descontínua do tumor ósseo primário (skip metástase), no envolvimento de outras estruturas, como feixes vásculo-nervosos e menor margem de ressecção. A superfície externa deve ser cuidadosamente examinada antes da dissecção. A pele e os tecidos moles devem ser inspecionados quanto à enduração ou à presença de outras alterações. Áreas de incisões prévias e de biópsia devem ser identificadas e analisadas quanto ao implante tumoral no trajeto da agulha. As margens devem ser amostradas com base nos exames macroscópico e de imagem. Representar áreas correspondentes à menor margem livre de partes moles, à margem de ressecção óssea e à margem de ressecção articular sinovial.
- Recomenda-se o uso de serra-fita elétrica (de açougueiro) para a secção do osso comprometido, posicionando o corte no sentido do maior eixo da lesão. Também se deve atentar à maior extensão da invasão tumoral das partes moles.
- Em se tratando de lesão suspeita de osteoma osteoide, o reconhecimento da presença do nidus é importante e pode ser observada por transiluminação, seguida da secção, a qual deve ser feita sempre no sentido da superfície da região cortical para a superfície endosteal.
- As peças devem ser escovadas para a retirada do pó de osso, uma vez que, este pode causar artefatos nos cortes histológicos.
Nota: Em caso de avaliação do efeito quimioterápico (índice de necrose de Huvos), a representação de toda a massa tumoral é impraticável, então, recomenda-se a fatia central que melhor represente o tumor. Esta deve ser mapeada, utilizando uma grade, para identificar cada porção do tumor, bem como as respectivas margens cirúrgicas: ósseas, articulares sinoviais e de partes moles. Cada divisória da grade não deve ultrapassar as dimensões de um cassete, e os fragmentos obtidos não devem ser muito espessos (em torno de 2 a 3 mm) para boa fixação tecidual e adequado processamento técnico após a descalcificação do material. Sugere-se, para confecção da grade, utilizar imagem fotográfica ou digitalizada da peça, radiografia, fotocópia ou, simplesmente, desenhar a peça com o respectivo tumor (Figura 1). O plano de mapeamento para estudo do efeito do tratamento quimioterápico, em caso de osteossarcoma, também pode ser usado para avaliação de outros sarcomas ósseos pós-quimioterapia (ver item a seguir).
V.4 Protocolo anatomopatológico para osteossarcoma pós-quimioterapia usado na Universidade Estadual de Campinas (Unicamp)
V.4.1 Macroscopia
Osso comprometido ____________________
Ressecção do tipo _____________________
Medidas da peça ____ cm
Tumor ____ cm
Menor margem livre ____ cm
V.4.2 Localização, extensão e características do tumor
□ Terço proximal □ De superfície □ Comprometimento linfonodo regional
□ Terço medial □ Lesões-satélite □ Necrose
□ Terço distal □ Invasão da cartilagem epifisária □Hemorragia
□ Epífise □ Invasão da cápsula articular □ Degeneração cística
□ Metáfise □ Rotura cortical □ Ossificação/calcificação
□ Diáfise □ Comprometimento das partes moles □ Áreas condroides
Intramedular Comprometimento da pele (trajeto de biópsia) Outros
V.4.3 Desenho da peça, mapeamento (grade) e representação (Figura 1 e Tabela 1)
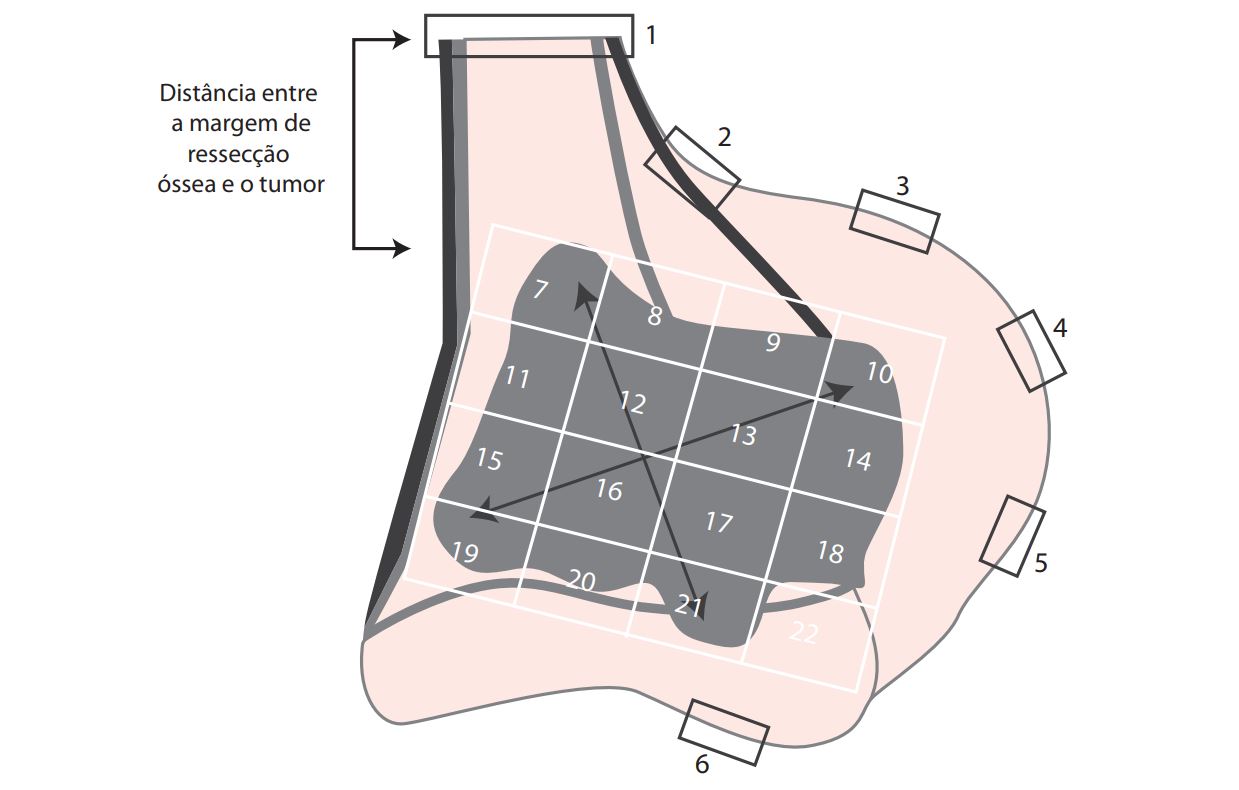
Figura 1 Desenho da peça com o respectivo tumor, mapeamento e representação (adaptado de Czerniak B, 2016).
Tabela 1 Fragmentos retirados.
| Lâmina/sigla | Identificação | N° de fragmentos | % do tumor viável |
| Total |
V.4.4 Microscopia
V.4.4.1 Biópsia anterior
- Sim (no_________)
- Não
V.4.4.2 Padrão histológico predominante
- Osteoblástico
- Condroblástico
- Fibroblástico
- Pequenas células
- Rico em células gigantes
- Telangiectásico
- Anaplásico
- Misto
- Epitelioide
- Esclerosante
- Outros (especificar) ___________________
V.4.4.3 Anaplasia celular
- Focal
- Difusa
V.4.4.4 Índice mitótico ____ /10 campos de maior aumento
V.4.4.5 Alterações histopatológicas predominantes pós-quimioterapia: celularidade tumoral e estroma
- Núcleos bizarros
- Homogeneização da cromatina
- Vacuolização citoplasmática
- Necrose focal
- Necrose extensa
- Desaparecimento de tecido neoplásico
- Macrófagos espumosos
- Células gigantes bizarras
- Fibroblastos aberrantes
- Fibrose estromal
- Degeneração mixoide
- Degeneração cística
- Osso residual
- Matriz óssea tumoral acelular
- Calcificação
- Espessamento da íntima – vasos
- Trombose
- Êmbolos neoplásicos
V.4.5 Margens
- Ósseas ____ mm
- Partes moles ____ mm
Menor margem livre ____ mm
V.4.6 Viabilidade de neoplasia pós-quimioterapia (____%) (modificado de Huvos, 1991)
- Grau 1 – Nenhuma ou mínima necrose
- Grau 2 – Extensa necrose com mais de 10% de tumor viável
- Grau 3 – Extensa necrose com esparsos focos de tumor viável (< 10%)
- Grau 4 – Necrose completa
V.5 Avaliação de necrose pós-quimioterapia
A necrose tumoral é caracterizada pela morte da célula sarcomatosa, picnose e fragmentação nuclear ou completo desaparecimento do tecido tumoral. Alterações pré-necróticas atribuídas à quimioterapia consistem em desenvolvimento de núcleos bizarros, homogeneização da cromatina e vacuolização citoplasmática. A eliminação do tecido neoplásico é substituída por estroma hialinizado e vascularizado. Cavidades císticas preenchidas por material mucoide, matriz óssea tumoral amorfa ou calcificada e osso residual acelular podem ser detectados. O índice de resposta à quimioterapia pode ser graduado. A graduação de Huvos (1991) é a mais utilizada.
Recomenda-se que a avaliação do grau de necrose seja feita analisando cada uma das lâminas, segundo o mapeamento da peça, detectando-se, em cada uma delas, a porcentagem da extensão da necrose. A porcentagem final é dada pela média aritmética da soma de todas as lâminas examinadas. É mais trabalhosa, porém mais acurada. Alguns serviços avaliam a necrose pela simples detecção de células viáveis (+) ou necróticas (-) na lâmina, independentemente da extensão. Assim, um pequeno agrupamento de células tumorais viáveis em uma lâmina corresponderá à positividade semelhante, se esta tiver extensas áreas de tumor viável, superestimando o grau de positividade, ou seja, a resistência à droga ou a má resposta à quimioterapia. Em termos da graduação de Huvos, em alguns casos, pode ser atribuído grau 2 ou 3, na dependência do método utilizado, o que implicará terapêutica e prognóstico distintos.
Nota: Fotografar a peça antes e depois de seccionada e tirar duas ou mais fatias de 3 a 5 mm para melhor fixação e descalcificação, quando a peça requerer índice de necrose, proceder da maneira descrita na Nota do item “V.3 Secção”.
V.6 Inclusão
- Incluir os tecidos moles antes do osso.
- Incluir o material na totalidade quando menor de 3 cm ou se for suspeito de tumor cartilaginoso clássico ou não houver visualização da lesão.
• Incluir o material que, macroscopicamente, represente a lesão.
V.7 Fixação e descalcificação
É usada formalina a 10% ou formalina tamponada que preserva melhor o tecido (jamais proceder a descalcificação sem antes fixar o tecido por, pelo menos, 24 horas). A descalcificação é feita com ácido nítrico de 5 a 7,5%, ou ácido fórmico de 8 a 10% (menor prejuízo a imunogenicidade da amostra), tomando-se o cuidado de deixar os fragmentos, imersos em ácido, suspensos por um fio de linha, de forma que não tenham contato com o fundo do recipiente. Deve-se trocar o ácido diariamente e verificar se os fragmentos estão descalcificados. Essa avaliação pode ser feita, primeiramente, espetando-se o fragmento com agulha fina, depois basta tentar afiná-los a uma espessura de 2 a 3 mm, cortando-os com uma navalha nova. Se o corte for suave, ou seja, sem evidência de calcificação tecidual, pode-se colocar os fragmentos em cassetes e deixá-los em água corrente por 20 minutos, no mínimo. Retirar os cassetes, sacudi-los para tirar o excesso de água e colocá-los em formol para, então, seguir o processamento técnico histológico habitual. Pode-se usar o ácido de descalcificação rápida (RDO), mas com muito cuidado para não descalcificar em excesso. Pode-se também usar o descalcificador utilizado no MGH-Boston-USA (Tabela 2). Neste caso, deve-se submeter o tecido ao descalcificador por, no máximo, 8 horas. Repetir o processo, se necessário. Conforme o tamanho ou a concentração de cálcio no tecido, o tempo de exposição do fragmento ao descalcificador pode variar de 2 a 8 horas. De preferência, não deixar o material no descalcificador durante a noite; repetir a operação durante o dia.
Tabela 2 Descalcificador usado no MGH-Boston USA.
| Descalcificador | Quantidade |
| EDTA tetrassódico | 7 g |
| Tartarato de sódio e potássio | 80 g |
| Ácido clorídrico | 1.200 mL |
| Água destilada | 9.000 mL |
VI. Exame microscópico
Tipo histológico (classificação da OMS [2013], modificada)
VI.1 Graduação histológica (neoplasias malignas)
- Grau I – Bem diferenciado (G1)
- Grau II – Moderadamente diferenciado (G2)
- Grau III – Pouco diferenciado (G3)
VI.2 Tumores formadores de osso
VI.2.1 Benignos
- Osteoma
- Osteoma osteoide
- Osteoblastoma
VI.2.2 Malignos
Osteossarcoma
- Central (medular)
- Clássico ou convencional (G3)
- Osteoblástico
- Condroblástico
- Fibroblástico
- Rico em células gigantes
- Epitelioide
- De células claras
- Osteoblastoma-like (G1)
- Condroblastoma-like
- Telangiectásico (G3)
- Pequenas células (G3)
- Bem diferenciado central (G1)
- Secundário
- À doença de Paget (G3)
- Pós-irradiação (G3)
- Superfície (periférico)
- Clássico (alto grau) G3)
- Periosteal (G2)
- Parosteal (G1)
- Clássico ou convencional (G3)
VI.3 Tumores formadores de cartilagem
VI.3.1 Benignos
- Osteocondroma
- Solitário
- Em osteocondromatose múltipla
- Condroma
- Encondroma solitário
- Em encondromatose múltipla
- Periosteal
- Condromatose sinovial
- Condroblastoma
- Condroma fibromixoide (fibroma condromixoide)
VI.3.2 Malignos
- Condrossarcoma
- Clássico:
- Central ou de superfície/periférico;
- Primário ou secundário (G1-G3)
- Desdiferenciado (G3)
- De células claras (G1)
- Mesenquimatoso (G3)
VI.4 Tumores fibrogênicos
- Fibroma desmoplásico*¹
- Fibrossarcoma (G3)
VI.5 Tumores fibro-histiocíticos
- Fibroma não ossificante*²
- Fibro-histiocitoma benigno*²
- Sarcoma indiferenciado de alto grau (Fibro-histiocitoma maligno, de classificações anteriores) (G3)
VI.6 Tumores vasculares*³
- Hemangioma
- Hemangioma epitelioide
- Hemangioendotelioma epitelioide (G1-G2)
- Angiossarcoma (G3)
VI.7 Tumores giganto-celulares
- Granuloma reparador de células gigantes
- Tumor de células gigantes do osso (TGC) (G1) *4
- Malignização em tumor de células gigantes (G3)
VI.8 Tumores da família do Sarcoma de Ewing/Tumor neuro-ectodérmico primitivo (PNET) (G3)
VI.9 Tumores hematopoiéticos
- Linfomas (primário e secundário)*5
- Mieloma
VI.10 Tumores lipogênicos
- Lipoma
- Lipossarcoma (G3)
VI.11 Tumores de músculo liso
- Leiomioma
- Leiomiossarcoma (G3)
VI.12 Tumores da notocorda
Benigno:
- Tumor notocordal benigno
Maligno:
- Cordoma (G2)
VI.13 Adamantinoma (G2)
VI.14 Metástases
VI.15 Miscelânea/lesões pseudoneoplásicas
- Cisto ósseo aneurismático*¹
- Cisto ósseo juvenil (simples/unicameral)
- Displasia fibrosa
- Displasia osteofibrosa*¹
- Histiocitose de células de Langerhans
- Doença de Erdheim-Chester
- Hamartoma condro-mesenquimatoso da parede torácica
- Tumor marrom do hiperparatireoidismo
*Nota 1: Fibroma desmoplásico; cisto ósseo aneurismático e displasia osteofibrosa são lesões benignas, mas com potencial de recorrência local.
*Nota 2: Fibroma não ossificante e fibro-histiocitoma benigno são lesões fibro-histiocíticas benignas de morfologia semelhante, porém, são consideradas entidades clínico-patológicas distintas.
*Nota 3: Hemangioma epitelioide é considerado benigno, mas localmente agressivo; já o hemangiendotelioma epitelioide é considerado maligno (grau baixo a intermediário), e o envolvimento de dois ou mais ossos está associado com pior prognóstico.
*Nota 4: Tumor de células gigantes, em geral, tem um comportamento benigno. Contudo, pode ser localmente agressivo com extensão aos tecidos moles e/ou recorrência (15-50%). À distância, pode exibir implante/metástase pulmonar em até 2% dos casos. Recomenda-se utilizar o termo “implante pulmonar” devido ao seu curso de crescimento lento; a lesão, em geral, é única e pode evoluir com cura pós-ressecção ou, mesmo, sofrer involução espontânea.
*Nota 5: Os linfomas são classificados como os linfonodais. O primário do osso tem melhor prognóstico que os secundários a linfomas nodais.
VII. Extensão da lesão
- Cortical (intracompartimental)
- Além da cortical (extracompartimental)
VIII. Margens de ressecção
VIII.1 Características
- Ressecção intralesional: ressecção com invasão do leito do tumor e realizada por curetagem ou enucleação.
- Ressecção marginal: ressecção em bloco do tumor e o plano de dissecção segue a área reacional peritumoral ou pela pseudocápsula do tumor.
- Ressecção ampla: ressecção em bloco, com margens amplas, ou seja, o plano de dissecção prossegue por tecido normal e por fora da área reativa peritumoral.
- Ressecção radical: ressecção em bloco de todos os compartimentos envolvidos pela neoplasia.
VIII.2 Comprometimento da margem
- Ausente, menor margem livre (especificar) __________________________
- Presente (especificar) __________________________________________
IX. Linfonodos
- Presentes
- Ausentes
- Ausência de metástases
Metástases ____ em ____ de linfonodos coletados
X. Exame de congelação
- Não realizado
- Realizado
- Do tumor
- Negativo
- Positivo
- Inconclusivo
- Da margem
- Negativo
- Positivo
- Inconclusivo
XI. Estudos especiais (especificar)
- Imuno-histoquímica _______________________________________________
- Citogenética_____________________________________________________
- Análise molecular ________________________________________________
- Análise citométrica _______________________________________________
XII. Diagnóstico final (exemplos)
- Produto de biópsia de lesão epifisária de úmero proximal direito: condroblastoma.
- Produto de biópsia a céu aberto de lesão epifisária de fêmur distal esquerdo: tumor de células gigantes.
- Produto de biópsia por agulha de lesão metafisária de fêmur distal esquerdo: osteossarcoma parosteal (grau 1).
- Produto de ressecção do segmento distal do fêmur direito após QT-neoadjuvante: osteossarcoma clássico central (grau 3), subtipo histológico predominante: osteoblástico, da metáfise distal do fêmur direito, extra-compartimental. Feixes vasculo-nervosos e margens de ressecção cirúrgicas livres, sendo a menor margem livre óssea (proximal) de 4,4 cm e a de partes moles (medial) de 0,8 cm.
Índice de necrose/resposta tumoral (Huvos) = grau 3.
XIII. Classificação TNM dos sarcomas ósseos (AJCC, 2017)
Definição de Tumor Primário (T)
Esqueleto apendicular; tronco e ossos craniofaciais
- TX – Não pode ser avaliado
- T0 – Não há evidência de tumor primário
- T1 – Tumor menor ou igual a 8 cm no maior diâmetro
- T2 – Tumor maior que 8 cm no maior diâmetro
- T3 – Tumor descontínuo do sítio ósseo primário
Coluna vertebral
- TX – Não pode ser avaliado
- T0 – Não há evidência de tumor primário
- T1 – Tumor confinado a um segmento vertebral ou dois segmentos vertebrais adjacentes
- T2 – Tumor confinado a três segmentos vertebrais adjacentes
- T3 – Tumor confinado a quatro segmentos vertebrais adjacentes, ou qualquer segmento vertebral não adjacente
- T4 – Extensão para o canal espinhal ou grandes vasos
- T4a – Extensão para o canal espinhal
- T4b – Evidência de invasão vascular macroscópica ou trombo tumoral em grandes vasos
Pelve
- TX – Não pode ser avaliado
- T0 – Não há evidência de tumor primário
- T1 – Tumor confinado a um segmento pélvico sem extensão extra-óssea
- T1a – Tumor menor ou igual a 8 cm no maior diâmetro
- T1b – Tumor maior que 8 cm no maior diâmetro
- T2 – Tumor confinado a um segmento pélvico com extensão extra-óssea ou dois segmentos sem extensão extra-óssea
- T2a – Tumor menor ou igual a 8 cm no maior diâmetro
- T2b – Tumor maior que 8 cm no maior diâmetro
- T3 – Tumor abrangendo dois segmentos pélvicos com extensão extra-óssea
- T3a – Tumor menor ou igual a 8 cm no maior diâmetro
- T3b – Tumor maior que 8 cm no maior diâmetro
- T4 – Tumor abrangendo três segmentos pélvicos ou ultrapassando a junção sacro-ilíaca
- T4a – Tumor envolve a junção sacro-ilíaca com extensão medial para o neuroforame sacral
- T4b – Tumor envolve os vasos ilíacos externos ou a presença de trombo tumoral macroscópico em grandes vasos pélvicos
Definição de Linfonodo Regional (N)
- NX – Não podem ser avaliados*
- N0 – Ausência de metástase linfonodal
- N1 – Metástases em linfonodo regional
Nota*: Em razão da raridade de envolvimento linfonodal em sarcomas, a designação “NX” pode não ser apropriada e pode ser considerada “N0” se nenhum envolvimento clínico for evidente.
Definição de Metástase à Distância (M)
- M0 – Ausência de metástase a distância
- M1 – Presença de metástase a distância
- M1a – Pulmonar
- M1b – Outros sítios distantes
Tabela 3 Grau histológico (adaptado de AJCC, 2017)
| Sistema em 2 graus | Sistema em 3 graus | G Definição (G) |
| GX Grau não pode ser avaliado | ||
| Baixo grau | Grau 1 | G1 Bem diferenciado, baixo grau |
| Alto grau | Grau 2 Grau 3 |
G2 Moderadamente diferenciado, alto grau
G3 Pouco diferenciado, alto grau |
Grupos de estadio prognóstico da AJCC, 2017
Tabela 4 Esqueleto apendicular; tronco e ossos craniofaciais
| Quando o T é: | Quando o N é: | Quando o M é: | E o Grau é: | O Grupo de Estadio é: |
| T1 | N0 | M0 | G1 ou GX | IA |
| T2 | N0 | M0 | G1 ou GX | IB |
| T3 | N0 | M0 | G1 ou GX | IB |
| T1 | N0 | M0 | G2 ou G3 | IIA |
| T2 | N0 | M0 | G2 ou G3 | IIB |
| T3 | N0 | M0 | G2 ou G3 | III |
| Qualquer T | N0 | M1a | Qualquer G | IVA |
| Qualquer T | N1 | Qualquer M | Qualquer G | IVB |
| Qualquer T | Qualquer N | Mb1 | Qualquer G | IVB |
Tumor ósseo primário em Coluna vertebral e pelve: não existe nenhum grupo de estadio prognóstico da AJCC para coluna vertebral e pelve.
XIV. Classificação TNM dos tumores ósseos malignos (UICC, 2017)
Tabela 5 Estadiamento TNM.
| Estadio | T | N | M | Grau |
| IA | T1 | N0 | M0 | G1, GX Baixo grau |
| IB | T2, T3 | N0 | M0 | G1, GX Baixo grau |
| IIA | T1 | N0 | M0 | G2, G3 Alto grau |
| IIB | T2 | N0 | M0 | G2, G3 Alto grau |
| III | T3 | N0 | M0 | G2, G3 Alto grau |
| IVA | Qualquer T | N0 | M1a | Qualquer grau |
| IVB | Qualquer T | N1 | Qualquer M | Qualquer grau |
| IVB | Qualquer T | N0 | M1b | Qualquer grau |
Tabela 6 Fatores prognósticos para osteossarcoma
| Fatores Prognósticos | Relacionado ao tumor | Relacionado ao hospedeiro | Relacionado ao ambiente |
| Essenciais | Localização, tamanho, extensão da doença
Resposta tumoral à QT-Neoadjuvante |
Idade | Doença residual pós-ressecção |
| Adicionais | LDH
Fosfatase alcalina |
Gênero
Performance “status” |
Equipe multidisciplinar de tratamento de sarcoma
Recorrência local |
| Novos e promissores | Biomarcadores |
XV. Estadiamento de Enneking
Tabela 7 Estadiamento de Enneking* simplificado.
| Estádio | Grau | Localização |
| IA | Baixo grau | Intracompartimental |
| IB | Baixo grau | Extracompartimental |
| IIA | Alto grau | Intracompartimental |
| IIB | Alto grau | Extracompartimental |
| III | Qualquer grau | Metástase |
*O estadiamento de Enneking é mais usado em sarcomas ósseos.
XVI. Alguns marcadores auxiliares do diagnostico uteis em patologia óssea:
XVI.1 Imuno-histoquímica
- H3G34W – Altamente especifico para TCG
- 3K36M – Altamente especifico para condroblastoma
- S100 – Condrócitos e condroblastos
- SOX9 – Condroblastos e células condroprogenitoras
- CD1a – Células de Langerhans
- Braquiúria – Células da notocorda
- CAMTA1, FLI1 – Tumores vasculares
- CD99, FLI1 – Família Sarcoma de Ewing/PNET
- MDM2, CDK4 – Osteossarcoma central de baixo grau e osteossarcoma parosteal
XVI.2 Técnicas moleculares
- Rearranjos de USP6 – Cisto ósseo aneurismático
- Rearranjos de GNAS – Displasia fibrosa
- Rearranjos de FOS e FOSB – Osteoblastoma
- Rearranjos de IDH1/2 – Condrossarcoma
- Rearranjos de EWSR1 e CIC-DUX4 – Família Sarcoma de Ewing/PNET
- Amplificação gênica de MDM2 e CDK4 – Osteossarcoma central de baixo grau e osteossarcoma paraosteal
XVII. Bibliografia
Amin MB, Edge SB, Greene FL, Byrd DR, Brookland RK, Washington MK, et al. AJCC Cancer staging manual, 8th ed. Switzerland: Springer, 2017.
Baumhoer D, Amary F, Flanagan AM. An update of molecular pathology of bone tumors. Lessons learned from investigating samples by next generation sequencing. Genes Chromosomes Cancer. 2019;58(2):88-99.
Brierley JD, Gospodarowicz MK, Wittekind C, O`Sullivan B, Mason M, Asamura H, et al. Union for International Cancer Control (UICC): TNM classification of malignant tumors, 8th ed. Oxford: John Wiley & Sons, Ltd, 2017.
Czerniak B. In Dorfman and Czerniak`s Bone Tumors, 2nd ed. Philadelphia, Elsevier, 2016.
Enneking WF, Spanier S, Goodman M. A system for the surgical staging of musculoskeletal sarcoma. Clin Orth Rel Res. 1980; 153:106-20.
Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F (eds.). WHO Classification of tumors of soft tissue and bone, 4th ed. Lyon: IARC, 2013.
Mangham DC, Athanasou NA. Guidelines for histopathological specimen examination and diagnostic reporting of primary bone tumours. Clin Sarcoma Res. 2011;1(1):6.
Rubin BC, Antonescu CR, Gannon FH, et al. Members of the Cancer Committee, College of American Pathologists. Protocol for the examination of specimens from patients with tumors of bone. Arch Pathol Lab Me. 2010; 134(4): e1-7.
Santini-Araujo E, Kalil RK, Bertoni F, Park Y-K. Tumors and tumor-like lesions of bone. London: Springer-Verlag, 2015.
Schaefer IM, Hornick JL. Diagnostic Immunohistochemistry for Soft Tissue and Bone Tumors: An Update. Adv Anat Pathol. 2018;25(6):400-12.
Voltar para a página inicial do manual