Luiz Antônio Rodrigues de Freitas
Ricardo Artigiani Neto
Introdução
O presente protocolo deve ser utilizado em carcinomas invasivas da vesícula biliar e também nos localizados no ducto cístico.
Código de topografia
C23 Neoplasia maligna da vesícula biliar
C24.4 Neoplasia maligna de ducto cístico
I. Identificação
II.Resumo clínico
Não há manifestações clínicas específicas. Algumas condições estão associada a risco
- Litíase
- Colangite esclerosante primária
- Junção pancreatobiliar anômala (do colédoco com o ducto pancreático principal (Wirsung) acima do esfíncter de Oddi)
III. Exame macroscópico
III.1 Procedimento cirúrgico
- Colecistectomia simples:
- Cirurgia aberta
- Laparoscópica
- Colecistectomia radical (com hepatectomia e linfadenectomia)
- Outro (especificar): __________
- Não especificado
III.2 Condição do material (vesícula biliar)
- Enviada aberta
- Fechada
- Enviada fragmentada
- Outra (especificar)
III.3 Cálculos
- Ausentes
- Presentes
III.4 Localização do tumor (Figura 1)
Em relação à topografia da vesícula biliar:
- Fundo
- Corpo
- Colo da vesícula
- Ducto cístico
- Não pode ser determinada
Em relação à face da vesícula biliar:
- Face hepática
- Face peritoneal
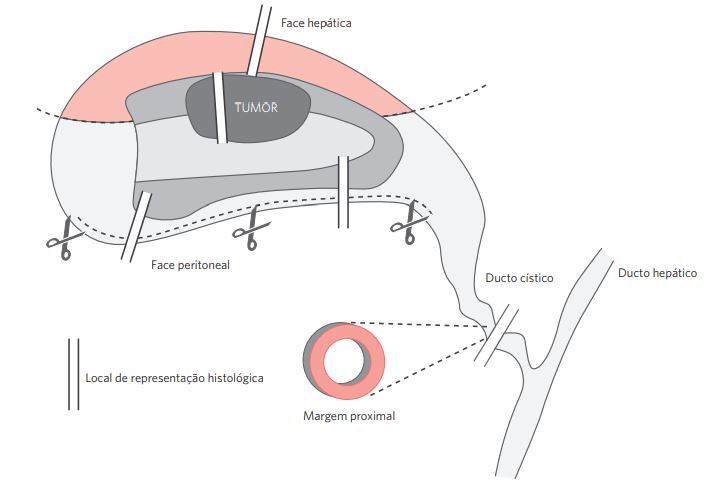
Figura 1 Localização do tumor na vesícula biliar.
III.5 Aspecto do tumor
- Plano
- Infiltrativo difuso
- Exofítico
- Outra (especificar) _________
III.6 Tamanho do tumor
Medidas do tumor: ___ x ___x___ (cm):
- Não pode ser determinado
III.7 Extensão macroscópica do tumor
- Limitado à parede
- Invasivo na superfície serosa
- Invasivo na superfície hepática
- Infiltração do fígado
- Outras:
IV. Exame microscópico
IV.1 Tipo histológico (segundo OMS, 2018)
- Adenocarcinoma SOE
- Adenocarcinoma, tipo biliar
- Adenocarcinoma, tipo intestinal
- Adenocarcinoma de células claras, SOE
- Adenocarcinoma mucinosa
- Neoplasia mucinosa cística com carcinoma invasivo associado
- Carcinoma de células pouco coesas
- Neoplasia papilar intracística com carcinoma invasivo associado
- Carcinoma escamocelular, SOE
- Carcinoma indiferenciado, SOE
- Carcinoma adenoescamoso
- Tumores neuroendócrinos, SOE
- Tumor neuroendócrino, grau 1
- Tumor neuroendócrino, grau 2
- Tumor neuroendócrino, grau 3
- Carcinoma neuroendócrino, SOE
- Carcinoma neuroendócrino de grandes células
Carcinoma neuroendócrino de pequenas células
- Neoplasia mista neuroendócrina – não neuroendócrina (MINEN)
IV.2 Graduação histológica
- G1 – Bem diferenciado
- G2 – Moderadamente diferenciado
- G3 – Pouco diferenciado
- Outro: ___________________________
IV.3 Extensão microscópica do tumor
- Sem evidências de tumor (T0)
- Invade a lâmina própria (T1a)
- Invade a camada muscular (T1b)
- Invade o tecido conjuntivo peri-muscular na face do peritônio, sem comprometer a serosa (T2a)
- Invade o tecido conjuntivo peri-muscular na face hepática da vesícula biliar, sem comprometer o fígado (T2b)
- Invade o peritônio visceral comprometendo a serosa e/ou diretamente o fígado e/ou um órgão ou estrutura adjacente como estômago, duodeno, cólon, pâncreas, omento ou ductos biliares extra-hepáticos (T3)
- Invade veia porta principal ou artéria hepática, ou invade dois ou mais órgãos ou estruturas extra-hepáticas (T4)
- Não pode ser avaliada
IV.4 Margens cirúrgicas
– Margem do ducto cístico:
- Não comprometida por neoplasia invasiva nem in situ
_ Distância da neoplasia da margem ___ (mm)
- Comprometida por neoplasia invasiva
- Comprometida por neoplasia intra-epitelial biliar de alto grau
- Não é possível avaliar
– Margem do fígado:
- Não comprometida por neoplasia invasiva
_ Distância da neoplasia da margem ___ (mm)
- Comprometida por neoplasia invasiva
- Não é possível avaliar
– Margem peritoneal:
- Não comprometida por neoplasia invasiva
_ Distância da neoplasia da margem ___ (mm)
- Comprometida por neoplasia invasiva
- Não é possível avaliar
IV.5 Invasão vascular
- Não detectada
- Presente
IV.6 Invasão perineural
- Não detectada
- Presente
IV.7 Linfonodos regionais
- Não submetidos a avaliação ou não encontrados
- Ausência de metástases (N0)
- Presença de metástases
- Metástases em linfonodos regionais (hilo hepático: linfonodos ao longo de ducto cístico, colédoco, artéria hepática e veia porta (N1)
– Número de linfonodos examinados ____
– Número de linfonodos comprometidos por metástases
IV.8 Achados patológicos adicionais
Inflamação:
- Ausente
- Colecistite aguda
- Colecistite crônica
- Colecistite hialinizante com calcificação focal (porcelana incompleta)
- Colecistite hialinizante com calcificação difusa (porcelana completa)
Colelitíase:
- Ausente
- Presente
Neoplasia intra-epitelial biliar:
- Baixo grau
- Alto grau
- Ausente
Adenoma
- Ausente
- Presente
Metaplasia Intestinal
- Ausente
- Presente
Colangite esclerosante primária
- Ausente
- Presente
V. Diagnóstico final (exemplo)
Produto de colecistectomia aberta: adenocarcinoma, tipo biliar, bem diferenciado, invasivo, localizado na face hepática da vesícula biliar, comprometendo toda a espessura da parede até o tecido hepático. O tumor mede 3 x 2 cm e tem padrão de crescimento exofítico e ulcerado. Está localizado a 4 cm da margem cirúrgica do ducto cístico e 2 cm da margem cirúrgica hepática. Apresenta êmbolos neoplásicos intravasculares e infiltração perineural multifocal. O epitélio adjacente exibe carcinoma in situ e displasia epitelial de alto grau.
Margem cirúrgica do ducto cístico a 4 cm da neoplasia está livre de comprometimento neoplásico.
Margem cirúrgica hepática livre de comprometimento neoplásico.
Outros achados: colecistite crônica calculosa com cálculos de colesterol.
Linfonodos do ducto cístico: presença de metástases em todos os dois linfonodos dissecados (2/2).
Estadiamento patológico (TNM, 2010): pT3, pN1.
VI. Comentários
VI.1 Estadiamento patológico (pTNM)
pT – Tumor primário
- pTX – O tumor primário não pode ser avaliado
- pT0 – Sem evidência de tumor primário
- pTis – Carcinoma in situ
- pT1 – O tumor invade a lâmina própria ou a camada muscular
- pT1a – O tumor invade a lâmina própria
- pT1b – O tumor invade a camada muscular
- pT2 – O tumor invade o tecido conjuntivo peri-muscular, mas sem invasão além da serosa ou do fígado
- pT2a – O tumor invade o tecido conjuntivo peri-muscular na face do peritônio, sem extensão para a serosa
- pT2b – O tumor invade o tecido conjuntivo peri-muscular na face do fígado, mas não se estende ao fígado
- pT3 – O tumor perfura a serosa (peritônio visceral) e/ou diretamente invade o fígado e/ou um outro órgão adjacente ou estrutura, como estômago, duodeno, cólon, pâncreas, omento ou ductos biliares extra-hepáticos
- pT4 – O tumor invade a veia porta principal ou a artéria hepática, ou múltiplos órgãos e estruturas extra-hepáticas
pN – Linfonodos regionais
- pNX – Linfonodos regionais não podem ser avaliados
- pN0 – Ausência de metástases em linfonodos regionais
- pN1 – Presença de metástases em linfonodos 1-3 linfonodos regionais
- pN2 – Presença de metástases em linfonodos 4 ou mais linfonodos regionais
pM – Metástases a distância
- Não aplicável
- pM1 – Metástases a distância
Tabela 1 Estadiamento anatômico/grupos prognósticos das neoplasias da vesícula biliar.
| Estádio | T | N | M |
| 0 | Tis | N0 | M0 |
| IA | T1a | N0 | M0 |
| IB | T1b | N0 | M0 |
| IIA | T2a | N0 | M0 |
| IIB | T2b | N0 | M0 |
| IIIA | T3 | N0 | M0 |
| IIIB | T1-3 | N1 | M0 |
| IVA | T4 | N0, N1 | M0 |
| IVB | Qualquer T | N2 | M0 |
| Qualquer T | Qualquer N | M1 |
VII. Considerações gerais
VII.1 Tipos macroscópicos
Os carcinomas de vias biliares extra-hepáticas podem ser classificados em três tipos macroscópicos: (1) tipo formador de massa: é o tipo mais frequente nos adenocarcinomas intra-hepáticos, mas raramente são vistos nos tumores da vesícula biliar; ; (2) tipo infiltrativo: o tumor infiltra-se difusamente ao longo da parede da vesícula biliar, onde aparem mal definidos e pouco. Mais de 60% dos tumores de vesícula biliar ocorrem no fundo, cerca de 30% no fundo e menos de 10% no colo da vesícula; (3) tipo exofítico: é um tipo mais raro que origina-se em neoplasia papilar intracolecística. Os tumores de vesícula biliar são difíceis de diferenciar no exame macroscópico de colecistite crônica.
VII.2 Tipos histológicos
Os tipos histológicos correspondem aos recomendados pela OMS (2019). A variante biliar é a mais frequente. Em relação ao prognóstico, os tumores papilares e os adenocarcinomas SOE, tipos intestinal e mucinoso, formam um grupo intermediário, enquanto os tumores com células em anel de sinete, sarcomatoide e de células claras têm comportamento mais agressivo. Em geral, vários subtipos se apresentam num mesmo tumor. O encontro de formas puras da variante células claras ou de células pouco coesas do tipo anel de sinete deve levantar a possibilidade de metástase ou infiltração de tumor de outros sítios primários (rim e estômago, respectivamente). Mesmo tipos intestinais puros merecem investigação de comprometimento vesical por adenocarcinoma de cólon.
VII.3 Graduação histológica
Os critérios para estabelecer os graus de diferenciação histológica dependem dos tipos histológicos. Quando os tumores são adenocarcinomas do tipo intestinal, podem ser adotados os critérios sugeridos para adenocarcinomas SOE proposto para tumores de cólon e reto pela OMS (2018). O grau nuclear e a arquitetura são levados em consideração nos outros adenocarcinomas. Os carcinomas escamocelulares são classificados segundo os critérios adotados em outros órgãos e tecidos (Broders, 1932). A graduação deve levar sempre em consideração a área menos diferenciada da neoplasia
VII.4 Extensão da infiltração do tumor
A extensão da neoplasia (o quanto invade a parede dos vesícula biliar) é um fator prognóstico relevante. A diferença de recidiva entre tumores classificados como T1 e T2 é significativa. Há dados da literatura sugerindo diferenças prognósticas entre tumores classificados com T2a e T2b. O T2b parece ter pior prognóstico. Quando ambas as faces da vesícula estão comprometidas, o tumor deve ser classificado com T2B. O comprometimento de seios de Rokitansky-Aschoff pelo tumor é considerado um fator prognóstico desfavorável independente. O encontro de Tis, correntemente denominada com neoplasia intra-epitelial biliar de alto grau, requer representação extensa da vesícula biliar no exame microscópico para afastar a possibilidade de uma neoplasia invasiva.
VII.5 Margens cirúrgicas
O comprometimento de margem é um fator relevante em recidivas e na sobrevida geral. Com frequência, os tumores são multicêntricos e se associam a carcinomas in situ de grande extensão.
VII.6 Infiltração perineural
Os dados sobre o significado prognóstico de invasão perineural são contraditórios. Há referência à relação prognóstica com invasão perineural extramural ou do plexo nervoso pancreático.
VII.7 Comprometimento de linfonodos
Há diferenças significativas de sobrevida quando não há comprometimento de linfonodos, quando 1 a 3 linfonodos estão comprometidos ou quando 4 ou mais linfonodos têm metástases.
VII.8 Avaliação Imunofenotipica
Os adenocarcinomas de vias biliares em geral são para citoqueratina 7, antígeno carcinoembrionário (CEA) e antígeno de membrana epitelial (EMA) positivos. São também positivos para citoqueratinas de alto peso molecular (p. ex., as marcadas pelo clone 34betaE12), o que pode ser útil para diferenciação com metástases do trato digestivo ou ginecológico. Além disso, muitos dos adenocarcinomas de vias biliares extra-hepáticas, incluindo a vesícula biliar, são positivos para MUC2 e para MUC5AC e quase todos são positivos para MUC1.
VII.9 Patologia molecular
Há poucos estudos moleculares e as alterações mais frequentemente descritas em adenocarcinomas de vias biliares extra-hepáticas incluem os genes KRAS, TP53, CDKN2A/B, ARID1A e PIK3CA. As alterações mais comuns nos tumores intra-hepáticos (IDH1, BAP1 e FGFR2) são raras nas neoplasias extra-hepáticas. Das alterações genéticas suscetíveis a terapias alvo-específicas, a mais frequente é a amplificação do ERBB2. Na sequência de progressão de displasia para carcinoma aumenta a frequência de mutações m CTNNB1 (beta-catenina). A frequência de casos com instabilidade de microssatélites é baixa, mas estudos preliminares com imunoterapia são suficientemente promissores para alguns oncologistas requisitarem a realização do teste. Em conclusão, com em tumores de outas localizações nas vias biliares, não há nenhuma recomendação formal para realização de testes moleculares.
Bibliografia
Adsay V, Saka B, Basturk O, Roa JC. Criteria for pathologic sampling of gallbladder specimens. Am J Clin Pathol. 2013;140(2):278-280.
Albores-Saavedra J, Shukla D, Carrick K, Henson DE. In situ and invasive adenocarcinomas of the gallbladder extending into or arising from Rokitansky-Aschoff sinuses: a clinicopathologic study of 49 cases. Am J Surg Pathol. 2004;28(5):621-628
Aloia TA, Járufe N, Javle M, et al. Gallbladder cancer: expert consensus statement. HPB (Oxford). 2015;17(8):681-690.
Amin, M.B; Greene, F.L.; Byrd, D.R.; Brookland, R. K.; Washington, M.K.; . Compton, C.C (Editores): AJCC Cancer Staging Manual, Eighth Edition, New York: Springer, 2018.
Balachandran P, Agarwal S, Krishani N, Pandey CM, Kumar A, Sikora SS et al. Predictors of long term survival in patients with gallbladder cancer. J Gastrointest Surg 2006; 10(6):848-54.
De la Cruz J, Hidalgo LA, Feliu J, Muñiz R, Del Bas M, Suñol X. Estadio tumoral, factores pronósticos, histológicos y de supervivencia en adenocarcinoma de vesícula biliar. Rev Españ Cirugía 2005; 77:18-21.
Kakar, S; Shi, C; N. Adsay, V; Fitzgibbons, P.L. MD; Frankel, W. I ; Krasinskas, A.M.; Pawlik, T.; Vauthey, J-N.; Washington,M.K: Protocol for the Examination of Specimens From Patients With Carcinoma of the Gallbladder. In https://webapps.cap.org/apps/docs/committees/cancer/cancer_protocols/2013/Gallbladder_13protocol_3102.pdf
Lowery MA, Ptashkin R, Jordan E, Berger MF, Zehir A, Capanu M, Kemeny NE,O’Reilly EM, El-Dika I, Jarnagin WR, Harding JJ, D’Angelica MI, Cercek A,Hechtman JF, Solit DB, Schultz N, Hyman DM, Klimstra DS, Saltz LB, Abou-Alfa GK. Comprehensive Molecular Profiling of Intrahepatic and Extrahepatic Cholangiocarcinomas: Potential Targets for Intervention. Clin Cancer Res. 2018;24(17):4154-4161.
Misra S, Chaturvedi A, Misra NC, Sharma ID. Carcinoma of the gallbladder. Lancet Oncology 2003; 4:167-76.
Roa,JC.; Adsay, NV.; Arola, J.; Tsui, WM.; Zen, Y: Carcinoma of the gallbladder. In: Nagtegaal, I; Odze, R.; Klimstra, D.; Paradis, V.; Rugge, M.; Schirmacher, P.; Carneiro, F.; Cree, I: WHO Classification of tumours of the digestive system (5a.ed). Geneva: WHO, 2019.
Roa JC, Tapia O, Manterola C, et al. Early gallbladder carcinoma has a favorable
outcome but Rokitansky-Aschoff sinus involvement is an adverse prognostic factor
Virchow Arch. 2013;463(5):651-61.
Shindoh J, de Aretxabala X, Aloia TA, et al. Tumor location is a strong predictor of tumor progression and survival in t2 gallbladder cancer: an international multicenter study. Ann Surg. 2015;261(4):733-739
Wistuba II, Gazdar AF. Gallbladder cancer: lessons from a rare tumor. Nature Rev Cancer 2004; 4:695-706.
Voltar para a página inicial do manual