Autores
Daniel Abensur Athanazio1,2, Luciana Schultz Amorim 3, Isabela Werneck da Cunha 4, Fabio Távora 5,6, Marcela Santos Cavalcanti 7, Stephania Martins Bezerra 8, Emilio Assis 9, Igor Campos da Silva 10, Fernando Korkes 11,12, Roni Fernandes 13, Igor Protzner Morbeck 14, Vinicius Carrera Souza 15, Katia Ramos Moreira Leite 16,17
Modelo de laudo – itens
1. A ser descrito pelo urologista (nota 1)
Procedimento:
- Biópsia da mucosa plana
- Ressecção transuretral de tumor da bexiga
- Biópsia de sítio de ressecção transuretral prévia
- Outro, especificar:
História clínica:
- Sobre o procedimento atual – ressecção completa de um tumor papilar de novo
- Sobre o procedimento atual – ressecção parcial de um tumor papilar de novo
- Sobre o procedimento atual – ressecção de um tumor papilar de novo em divertículo
- Diagnóstico prévio de carcinoma urotelial papilífero
- Tratamento prévio – BCG intravesical
- Tratamento prévio – quimioterapia intravesical
- Tratamento prévio – quimioterapia neoadjuvante
- Tratamento prévio – radioterapia (há quanto tempo)
- Outro, especificar:
Impressão à cistoscopia:
- Lesão plana
- Mucosa normal (biópsias randômicas)
- Tumor papilar exofítico
- Nodular
- Infiltrativo
- Lesão intramural
- Focalidade
- Área cicatrial ou área de lesão vista em cistoscopia prévia
- Leito tumoral para amostragem de camada muscular
- Outro, especificar:
Localização do tumor:
- Trígono
- Parede lateral direita
- Parede lateral esquerda
- Parede anterior
- Parede posterior
- Cúpula
- Outro, especificar:
2. A ser relatado pelo médico patologista
Biópsias e produtos de ressecção transuretral
Tipo histológico (para tumores uroteliais papilares não invasivos) (nota 2)
- Papiloma urotelial
- Papiloma urotelial, subtipo invertido
- Neoplasia urotelial papilar de baixo potencial de malignidade
- Neoplasia urotelial papilar de baixo potencial de malignidade, subtipo invertido
- Carcinoma urotelial papilar de baixo grau, não invasivo
- Carcinoma urotelial papilar de baixo grau, não invasivo, subtipo invertido
- Carcinoma urotelial papilar de alto grau, não invasivo
- Carcinoma urotelial papilar de alto grau, não invasivo, subtipo invertido.
- Carcinoma urotelial papilar, não invasivo, com predomínio de baixo grau histológico e componente menor (<5%) de alto grau
(Comentário sobre o ponto de corte de 5% e do comportamento mais próximo aos tumores de baixo grau nos casos com componente de alto grau < 5%)
Tipo histológico (para carcinomas invasivos) (nota 3)
- Carcinoma urotelial papilar, invasivo
- Carcinoma urotelial invasivo (não papilar)
- Carcinoma com extensa diferenciação escamosa
(Comentar sobre as limitações no espécime de ressecção transuretral para o diagnóstico diferencial entre carcinoma urotelial com diferenciação divergente ou carcinoma escamocelular puro)
- Carcinoma com extensa diferenciação glandular
(Comentar sobre as limitações no espécime de ressecção transuretral para o diagnóstico diferencial entre carcinoma urotelial com diferenciação divergente ou adenocarcinoma puro)
- Carcinoma neuroendócrino de pequenas células
- Carcinoma neuroendócrino de grandes células
- Outro, especificar:
Diferenciação divergente (aplica-se aos carcinomas uroteliais invasivos)
- escamosa (especificar percentagem)
- glandular (especificar percentagem)
- trofoblástica (especificar percentagem)
- mulleriana / carcinoma de células claras tipo mulleriano (especificar percentagem)
Subtipos (aplica-se aos carcinomas uroteliais invasivos)
- em ninhos (especificar percentagem)
- em grandes ninhos (especificar percentagem)
- micropapilar (especificar percentagem)
- linfoepitelioma-símile (especificar percentagem)
- plasmocitoide (especificar percentagem)
- sarcomatoide (especificar percentagem)
- de células gigantes (especificar percentagem)
- pouco diferenciado (especificar percentagem)
- rico em lipídios (especificar percentagem)
- de células claras / rico em glicogênio (especificar percentagem)
Gradação de carcinomas invasivos (nota 4)
- Para carcinoma urotelial: a maioria dos carcinomas invasivos é de alto grau.
Em casos de invasivos de baixo grau, comentar sobre a falta de dados que sugiram diferença de prognóstico em relação os carcinomas de alto grau.
- Para carcinoma escamocelular puro: G1, G2 e G3
- Outro, especificar:
Configuração do tumor (nota 5)
- Papilar exofítico
- Papilar endofítico / invertido (>80% de componente endofítico)
- Papilar exofítico, com componente menor endofítico / invertido
- Papilar exofítico ou endofítico, e infiltrativo
- Infiltrativo
- Plano
- Sólido / nodular
Extensão do tumor (para carcinomas invasivos) (nota 6)
- Lâmina própria
_ unifocal ou multifocal
_ localização da invasão: no eixo das papilas ou na base da lesão
(para tumores papilares)
_ tamanho máximo ou máxima profundidade de invasão (em milímetros)
- Muscular própria (músculo detrusor)
(Comentar sobre limitações para avaliar invasão além da muscular própria em espécimes de ressecção transuretral)
- Indefinido para invasão da camada muscular própria
(Comentário em casos de extenso tumor invasivo com reação desmoplásica do estroma / Considerar imunoistoquímica para desmina – smoothelin)
- Tecido adiposo
(Comentar sobre limitações para avaliar invasão além da muscular própria em espécimes de ressecção transuretral /
Relatar também máxima invasão observada independentemente da invasão observada do tecido adiposo)
- Estroma prostático
(Comentar sobre limitações para avaliar invasão além da muscular própria em espécimes de ressecção transuretral)
Comprometimento da uretra prostática por carcinoma urotelial (nota 7)
- Presença de extensão às glândulas prostáticas
- Presença de invasão do estroma prostático a partir da extensão uretral (pT2)
Invasão linfovascular (nota 8)
- Presente
- Não identificada
Muscular própria (músculo detrusor) na amostra (nota 9)
- Presente
- Não identificada
Outras lesões epiteliais (nota 10)
- Carcinoma urotelial in situ
- Displasia urotelial
- Atipia urotelial de significado indeterminado
- Proliferação urotelial de potencial de malignidade incerto / proliferação urotelial atípica, plana (ver apêndice)
- Proliferação urotelial de potencial de malignidade incerto / proliferação urotelial atípica, em tenda (ver apêndice)
Achados adicionais (nota 11)
- Inflamação / alterações epiteliais reparativas
- Adenoma nefrogênico
- Alterações associadas a tratamentos prévios
- Artefatos de termocoagulação
- Cistite cística
- Cistite glandular
- Metaplasia escamosa queratinizante
- Metaplasia intestinal
- Outro, especificar:
Espécime de ressecção cirúrgica:
Procedimento:
- Cistectomia parcial
- Cistectomia radical
- Cistoprostatectomia radical
- Exenteração pélvica anterior
- Outro, especificar:
Tipo histológico (para tumores uroteliais papilares não invasivos)
- Papiloma urotelial
- Papiloma urotelial, subtipo invertido
- Neoplasia urotelial papilar de baixo potencial de malignidade
- Neoplasia urotelial papilar de baixo potencial de malignidade, subtipo invertido
- Carcinoma urotelial papilar de baixo grau, não invasivo
- Carcinoma urotelial papilar de baixo grau, não invasivo, subtipo invertido
- Carcinoma urotelial papilar de alto grau, não invasivo
- Carcinoma urotelial papilar de alto grau, não invasivo, subtipo invertido.
- Carcinoma urotelial papilar, não invasivo, com predomínio de baixo grau histológico e componente menor (<5%) de alto grau
(Comentário sobre o ponto de corte de 5% e do comportamento mais próximo aos tumores de baixo grau nos casos com componente de alto grau < 5%)
Tipo histológico (para carcinomas invasivos)
- Carcinoma urotelial papilar, invasivo
- Carcinoma urotelial invasivo
- Carcinoma com extensa diferenciação escamosa
(Comentar sobre as limitações no espécime de ressecção transuretral para o diagnóstico diferencial entre carcinoma urotelial com diferenciação divergente ou carcinoma escamocelular puro)
- Carcinoma com extensa diferenciação glandular
(Comentar sobre as limitações no espécime de ressecção transuretral para o diagnóstico diferencial entre carcinoma urotelial com diferenciação divergente ou adenocarcinoma puro)
- Carcinoma neuroendócrino de pequenas células
- Carcinoma neuroendócrino de grandes células
- Outro, especificar:
Diferenciação divergente (aplica-se aos carcinomas uroteliais invasivos)
- escamosa (especificar percentagem)
- glandular (especificar percentagem)
- trofoblástica (especificar percentagem)
- mulleriana / carcinoma de células claras tipo mulleriano (especificar percentagem)
Subtipos (aplica-se aos carcinomas uroteliais invasivos)
- em ninhos (especificar percentagem)
- em grandes ninhos (especificar percentagem)
- micropapilar (especificar percentagem)
- linfoepitelioma-símile (especificar percentagem)
- plasmocitoide (especificar percentagem)
- sarcomatoide (especificar percentagem)
- de células gigantes (especificar percentagem)
- pouco diferenciado (especificar percentagem)
- rico em lipídios (especificar percentagem)
- de células claras / rico em glicogênio (especificar percentagem)
Gradação de carcinomas invasivos
- Para carcinoma urotelial: a maioria dos carcinomas invasivos é de alto grau
Em casos de invasivos de baixo grau, comentar sobre a falta de dados que sugiram diferença de prognóstico em relação os carcinomas de alto grau)
- Para carcinoma escamocelular puro: G1, G2 e G3
- Outro, especificar:
Configuração do tumor:
- Papilar exofítico
- Papilar endofítico / invertido (>80% de componente endofítico)
- Papilar exofítico, com componente menor endofítico / invertido
- Papilar exofítico ou endofítico, e infiltrativo
- Infiltrativo
- Plano
- Sólido / nodular
Extensão do tumor (para carcinomas invasivos)
- Lâmina própria
_ unifocal ou multifocal
_ localização da invasão: no eixo das papilas ou na base da lesão
(para tumores papilares)
_ tamanho máximo ou máxima profundidade de invasão (em milímetros)
- Muscular própria (músculo detrusor) – metade superficial
- Muscular própria (músculo detrusor) – metade profunda
- Partes moles perivesicais – microscópica
- Partes moles perivesicais – macroscópica (massa perivesical)
- Invasão de estruturas adjacentes
_ Estroma prostático (invasão transmural a partir da bexiga)
Comprometimento da uretra prostática por carcinoma urotelial
- Presença de extensão às glândulas prostáticas
- Presença de invasão do estroma prostático a partir da extensão uretral (pT2)
_ Vesículas seminais
_ Útero
_ Vagina
_ Anexos uterinos
_ Parede pélvica
_ Parede abdominal
_ Reto
- Outro, especificar:
Invasão linfovascular:
- Presente
- Não identificada
Margens de ressecção:
- Margem ureteral direita
- Margem ureteral esquerda
- Margem uretral
- Margem de partes moles
(Relatar como negativa ou envolvida por carcinoma invasivo, carcinoma urotelial in situ, ou carcinoma urotelial papilífero não invasivo)
Outras lesões epiteliais
- Carcinoma urotelial in situ
- Displasia urotelial
- Atipia urotelial de significado indeterminado
- Proliferação urotelial de potencial de malignidade incerto / proliferação urotelial atípica, plana (ver apêndice)
- Proliferação urotelial de potencial de malignidade incerto / proliferação urotelial atípica, em tenda (ver apêndice)
Observação: sugestões de notas: ver nos apêndices
Achados adicionais:
- Inflamação / alterações epiteliais reparativas
- Adenoma nefrogênico
- Alterações associadas a tratamentos prévios
- Artefatos de termocoagulação
- Cistite cística
- Cistite glandular
- Metaplasia escamosa queratinizante
- Metaplasia intestinal
- Outro, especificar:
Linfonodos regionais:
- Número de linfonodos com metástase / número de linfonodos identificados
_ tamanho do maior depósito metastático
_ extensão extranodal: ausente / presente
Estadiamento patológico
pT0: Nenhuma evidência de tumor primário
pTa: Carcinoma urotelial papilar não invasivo
pTis: Carcinoma urotelial in situ (lesão plana)
pT1: Invasão de lâmina própria (tecido conjuntivo subepitelial)
pT2: Invasão da camada muscular própria
___ pT2a: Invasão da camada muscular própria (metade superficial)
___ pT2b: Invasão da camada muscular própria (metade profunda)
pT3: Invasão de partes moles perivesicais
___ pT3a: Invasão de partes moles perivesicais, microscopicamente
___ pT3b: Invasão de partes moles perivesicais, macroscopicamente
(massa extravesical)
pT4: Tumor extravesical invade estroma da próstata, vesículas seminais, útero, vagina, parede pélvica, parede abdominal
pN0: Ausência de metástase para linfonodos
pN1: Metástase para um linfonodo na pelve verdadeira (perivesical, obturator, ilíaco interno, ilíaco externo, sacral)
pN2: Metástase para mais de linfonodo na pelve verdadeira (perivesical, obturator, ilíaco interno, ilíaco externo, sacral)
pN3: Metástase para linfonodos da cadeia ilíaca comum
pM (relatar apenas se confirmado patologicamente)
pM1: Metástase à distância
___ pM1a: Metástases para linfonodos não regionais (além da cadeia ilíaca comum)
___ pM1b: Metástases à distância não nodais
Grau de regressão do tumor (para paciente tratados com quimioterapia neoadjuvante)
(opcional)
- TRG1: leito tumoral com extensa fibrose e ausência de células neoplásicas viáveis
- TRG2: células neoplásicas residuais ocupam <50% do leito tumoral
- TRG3: células neoplásicas residuais ocupam ≥50% do leito tumoral
Obs. O tratamento neoadjuvante com quimioterapia tem sido preconizado com fator prognóstico de sobrevida câncer-específica. Quando a informação estiver disponível deve-se acrescentar “y” ao estadiamento. A resposta é considerada positiva quando o estadiamento for < ou igual a pT1.
Apêndice
Notas sugeridas para lesões planas com espessamento urotelial sem atipias:
PROLIFERAÇÃO UROTELIAL DE POTENCIAL DE MALIGNIDADE INCERTA (HIPERPLASIA UROTELIAL) / PROLIFERAÇÃO UROTELIAL ATÍPICA “EM TENDA” OU ONDULADA
- Camada muscular própria (músculo detrusor): não representada
Nota: a lesão observada mostra aumento da espessura urotelial sem atipias citológicas. Esta lesão – previamente denominada “hiperplasia urotelial” – foi renomeada como proliferação urotelial de potencial de malignidade incerto (U-PUMP) na classificação da OMS de tumores urinários de 2016. A lesão tem pequenos esboços papilares e – recentemente – a Genitourinary Pathology Society sugeriu a nomenclatura de proliferação urotelial atípica “em tenda” ou ondulada para estas lesões. Esta lesão é um potencial precursor do carcinoma urotelial papilífero de baixo grau. Metade destas lesões são clonais. Existem poucos dados sobre o risco de desenvolvimento de neoplasia em lesões sem histórico prévio de carcinoma urotelial. A estimativa, baseada em dados limitados, é que o risco de neoplasia urotelial no seguimento urológico em pacientes com esta lesão é cerca de 15% (na ausência de história de neoplasia urotelial) e de até 41% (se há histórico prévio de carcinoma urotelial). É recomendado acompanhamento do paciente e vigilância com cistoscopia.
Referência:
Amin MB, et al. The Genitourinary Pathology Society Update on Classification and Grading of Flat and Papillary Urothelial Neoplasia With New Reporting Recommendations and Approach to Lesions With Mixed and Early Patterns of Neoplasia. Adv Anat Pathol. 2021 Jul 1;28(4):179-195.
PROLIFERAÇÃO UROTELIAL DE POTENCIAL DE MALIGNIDADE INCERTA (HIPERPLASIA UROTELIAL) / PROLIFERAÇÃO UROTELIAL ATÍPICA PLANA
Nota: a lesão observada mostra aumento da espessura urotelial sem atipias citológicas. Esta lesão – previamente denominada “hiperplasia urotelial” – foi renomeada como proliferação urotelial de potencial de malignidade incerto (U-PUMP) na classificação da OMS de tumores urinários de 2016. Esta lesão é um potencial precursor do carcinoma urotelial papilífero de baixo grau. Metade destas lesões são clonais. Essas lesões são frequentemente consideradas lesão adjacente (“que ombreia”) carcinoma papilífero de baixo grau A estimativa, baseada em dados limitados, é que o risco de neoplasia urotelial no seguimento urológico em pacientes com esta lesão é cerca de 15% (na ausência de história de neoplasia urotelial) e de até 41% (se há histórico prévio de carcinoma urotelial). Recomenda-se acompanhamento do paciente e vigilância com cistoscopia.
Referência:
Amin MB, et al. The Genitourinary Pathology Society Update on Classification and Grading of Flat and Papillary Urothelial Neoplasia With New Reporting Recommendations and Approach to Lesions With Mixed and Early Patterns of Neoplasia. Adv Anat Pathol. 2021 Jul 1;28(4):179-195.
Notas explicativas
Nota 1
As informações clínicas mínimas devem incluir o seguinte:
- aspecto macroscópico à cistoscopia: lesão plana ou papilar
- se a amostra é de uma lesão de novo ou de um tumor recorrente
- localização do tumor
- o tipo de procedimento: biópsia, ressecção transuretral, biópsia incisional de um grande tumor, ressecção parcial ou total
- informação sobre se a ressecção é de um tumor de novo, segunda abordagem olhar de um tumor papilífero previamente ressecado, biópsias aleatórias durante o seguimento após o diagnóstico de carcinoma
- informações sobre terapias prévias, incluindo BCG intravesical, quimioterapia, quimioterapia sistêmica ou radioterapia.
- se houve alguma dificuldade durante o procedimento, como sangramento ou dificuldade de visualização.
- informações clínicas sobre outros tumores suspeitos ou previamente diagnosticados (por exemplo, próstata, útero, cólon). Estas informações são particularmente importantes para adenocarcinomas e neoplasias indiferenciadas.
A impressão clínica de uma lesão papilar pode levar o patologista a considerar cortes aprofundados do bloco histológico para encontrar morfologia papilar em uma amostra com configuração plana observada em cortes iniciais. Essa comunicação é essencial, uma vez que os espécimes RTU são fragmentos inerentemente não orientados, e uma pequena lesão papilar pode não ser prontamente identificada nos cortes iniciais.
Informações sobre a ressecção total do tumor são cruciais para o diagnóstico de papiloma urotelial e neoplasia urotelial papilífero de baixo potencial de malignidade (PUNLMP), uma vez que as atipias que caracterizam carcinomas não invasivos de baixo grau são comumente focais. O exame de toda a lesão é critério essencial para o diagnóstico do papiloma urotelial. Da mesma forma, mesmo um componente de atipia de alto grau tão pequeno quanto 5% de todo o tumor qualifica uma neoplasia urotelial papilar como carcinoma de alto grau (WHO 2022).
A informação sobre um diagnóstico prévio de carcinoma urotelial é fundamental porque excluir um diagnóstico prévio de malignidade urotelial é um critério essencial (WHO 2022) para o diagnóstico de PUNLMP na atual classificação.
A localização do tumor é essencial para a interpretação das lesões vesicais. Por exemplo, a metaplasia escamosa não queratinizante no trígono de mulheres é considerada uma variação normal da histologia vesical. Remanescentes de úraco e proliferações epiteliais relacionadas ao úraco podem ser considerados para lesões localizadas na cúpula e parede anterior.
O estadiamento dos carcinomas que surgem nos divertículos da bexiga difere de outras localizações, pois a ausência de muscular própria nessas lesões impede o estadiamento pT2. Além disso, variações anatômicas da muscular própria em diferentes áreas vesicais são essenciais para o estadiamento adequado. Os feixes musculares próprios são menores e mais próximos do urotélio (com escassa lâmina própria e submucosa) na área do trígono, colo vesical e sítios de inserção dos ureteres. O diagnóstico de carcinoma urotelial in situ é controverso em pacientes com carcinoma urotelial papilífero adjacente. Alguns autores recomendam não usar a terminologia de carcinoma urotelial in situ em uma segunda abordagem de RTU (ver discussão abaixo) após o diagnóstico de carcinoma urotelial papilífero. A informação de que a amostra é derivada de biópsias aleatórias da mucosa plana (longe de tumores ou sítio de RTU prévio) é vital para um diagnóstico direto de carcinoma urotelial in situ, sem a necessidade de comentários sobre como a interpretação depende do cenário observado na cistoscopia (Figura 1).
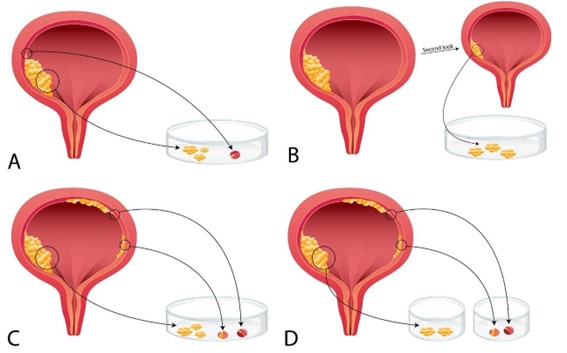
Figura 1. Em um espécime RTU é comum observar carcinoma urotelial papilífero de alto grau e atipia grave na mucosa plana urotelial. A interpretação desse achado pode variar em diferentes cenários. A informação adequada e a submissão em amostras separadas são cruciais. A Figura A ilustra a ressecção de um carcinoma urotelial papilífero de alto grau e uma lesão que ombreia a neoplasia papilar na mucosa plana adjacente. Com essas informações, é razoável inferir que a presença de atipia grave na mucosa plana adjacente derive da extensão do carcinoma papilífero para o epitélio adjacente. A Figura B ilustra a ressecção da mucosa plana (que pode mostrar atipias graves) em uma segunda abordagem de RTU após o diagnóstico de carcinoma urotelial papilífero de alto grau. Nesse cenário, é razoável interpretar o achado como lesão residual do ombro (de carcinoma papilífero de alto grau) da mucosa plana adjacente. As figuras C e D ilustram a amostragem de um tumor papilar e lesões planas afastadas da lesão exofítica. Em C, todas as amostras são apresentadas no mesmo recipiente. A interpretação neste cenário é difícil (ver texto para uma discussão mais aprofundada). Em D, com as devidas informações e submissão em separado, é fácil reconhecer um carcinoma urotelial papilífero de alto grau e carcinoma urotelial in situ concomitante (multifocal, com efeito de cancerização de campo).
A radioterapia pode induzir atipia nuclear grave em células uroteliais. Há uma sobreposição significativa entre os achados morfológicos do carcinoma urotelial in situ e alterações relacionadas ao efeito da radiação. Esta distinção não deve ser feita dentro de 12 meses após a radioterapia (Epstein e Netto 2014). Nas lesões planas, o conhecimento da exposição prévia à radiação e do tempo de duração é essencial para a interpretação da lesão pelo patologista.
A avaliação patológica adequada das lesões vesicais é influenciada por muitas ações do urologista, e sua importância deve ser destacada (Lopez-Beltran et al. 2004). O urologista deve:
- comunicar com o patologista todas as informações clínicas relevantes e impressão cistoscópica.
- encaminhar a peça cirúrgica com a melhor orientação possível, quando aplicável.
- considerar a ressecção em bloco/copo frio de pequenas lesões papilares.
- considerar a ressecção das lesões papilares e enviá-las em dois recipientes diferentes: um com o tumor superficial e outro com a parede profunda (para avaliação da muscular própria)
- para doença extensa, realizar biópsias aleatórias e biópsias da uretra prostática. Todos eles são enviados em diferentes contêineres.
- evitar demora desnecessária entre a retirada e fixação do tecido
- evitar artefatos térmicos/cauterizados desnecessários sempre que possível
- enviar cada lesão ou região em um recipiente diferente
Referências:
Epstein JI, Netto GJ (2014) Differential Diagnoses in Surgical Pathology: Genitourinary System. Lippincoty Williams and Wilkins, Philadelphia.
Lopez-Beltran A, Bassi PF, Pavone-Macaluso M, Montironi R; European Society of Uropathology; Uropathology Working Group (2004) Handling and pathology reporting of specimens with carcinoma of the urinary bladder, ureter, and renal pelvis. A joint proposal of the European Society of Uropathology and the Uropathology Working Group. Virchows Arch. 445(2):103-10.
WHO Classification of Tumours Editorial Board. Urinary and male genital tumors [Internet]. Lyon (France): International Agency for Research on Cancer; 2022 (WHO classification of tumors series, 5th ed.; vol. 8). Available from: https://tumourclassification.iarc.who.int/chapters/36.
Nota 2
Os termos carcinoma ou papiloma de células transicionais são considerados obsoletos. Os patologistas devem usar o tumor urotelial. Carcinomas uroteliais com morfologia papilífera devem ser diagnosticados como carcinoma urotelial papilífero, e a presença ou ausência de invasão deve ser explícita. O diagnóstico de “carcinoma urotelial papilífero invasivo” implica que a transformação oncogênica seguiu a via da neoplasia papilífero. O diagnóstico de “carcinoma urotelial invasivo” infere que o tumor provavelmente deriva da via plana (carcinoma in situ), que tende a dar origem a tumores mais agressivos e de crescimento rápido (Schultz 2018). As neoplasias uroteliais não invasivas devem ser classificadas em uma das quatro categorias: papiloma urotelial, neoplasia urotelial papilar de baixo potencial de malignidade (PUNLMP); carcinoma urotelial papilífero de baixo grau não invasivo; e carcinoma urotelial papilífero de alto grau não invasivo. Essa distinção é justificada pela diferença nas taxas de recorrência e progressão entre essas categorias (WHO 2022). O papiloma urotelial é benigno, com baixíssima taxa de recorrência e rara progressão (<1%). O carcinoma urotelial papilífero não invasivo de baixo grau tem uma taxa de recorrência de ~50% e progressão de grau ou estágio de 10-20%. O carcinoma urotelial papilífero de alto grau não invasivo tem uma taxa de recorrência de ~60% e progressão de estágio de 25% (WHO 2022).
O papiloma urotelial deve ser raramente diagnosticado. Utilizando-se critérios diagnósticos restritivos, o papiloma urotelial representa < 4% de todas as neoplasias uroteliais não invasivas. Geralmente é pequeno e solitário (WHO 2022). Como a atipia no carcinoma urotelial papilífero de baixo grau não invasivo é comumente focal, examinar toda a lesão é um critério essencial para o diagnóstico do papiloma urotelial (WHO 2022). Tal exigência ressalta a importância de informações clínicas/cistoscópicas para informar se a amostra é proveniente de biópsia incisional ou ressecção parcial ou total de tumor de bexiga. Se a comunicação com o urologista for impossível, é razoável tornar um diagnóstico “consistente com papiloma urotelial” com um comentário de que o exame de toda a lesão vista na cistoscopia é obrigatório. Isso evitaria um possível erro de diagnóstico quando um diagnóstico de papiloma urotelial é feito em uma pequena biópsia removida de um grande tumor ou doença multifocal que pode abrigar atipias não amostradas.
O PUNLMP não tem sido uniformemente utilizado como categoria diagnóstica em todo o mundo. Entretanto, sua preservação como entidade diagnóstica justifica-se pela recidiva intermediária e taxas de progressão entre o papiloma e o carcinoma urotelial papilífero de baixo grau não invasivo. Foram relatadas taxas de recorrência de 18-20% e taxas de progressão de 2-11% (Pan et al., 2010; Maxwell et al., 2015), com progressão principalmente para carcinoma urotelial papilífero não invasivo de baixo grau e ~1% de progressão para carcinoma urotelial invasivo (Maxwell et al. 2015). Dados são limitados sobre a recorrência de PUNLMP invertido, mas parece ser um evento raro (Maxwell et al. 2015).
Em um estudo de base populacional da Suécia, as taxas de recorrência de 5 anos de PUNLMP e carcinoma urotelial papilífero de baixo grau não invasivo foram de 21% e 42%, respectivamente; e as taxas de progressão foram de 0,7% e 4%, respectivamente (Bobjer et al. 2022). Nem todas as séries mostram diferenças na recorrência e progressão entre PUNLMP e carcinoma urotelial não invasivo de baixo grau. Em um estudo multicêntrico europeu-canadense, a taxa de recidiva em 5 anos foi de 51% para PUNLMP versus 48% para carcinoma urotelial papilífero de baixo grau. A progressão para doença músculo-invasiva foi semelhante nos dois grupos: 3,9% para PUNLMP versus 2,6% para carcinoma urotelial papilífero de baixo grau (Hentschel et al. 2020).
Embora o exame de toda a lesão não seja um critério essencial listado pela nova classificação da OMS, sugerimos – espelhando a abordagem para o diagnóstico do papiloma urotelial – uma comunicação próxima com o urologista para verificar se a lesão foi removida completamente. Se a comunicação com o urologista não for possível, é razoável tornar um diagnóstico “consistente com PUNLMP” com um comentário de que o exame de toda a lesão vista na cistoscopia é necessário.
A heterogeneidade de grau é comum em carcinomas uroteliais papilíferos não invasivos e ocorre em um terço dos casos. Embora baseada em dados limitados, a classificação da OMS de 2002 recomenda um ponto de corte de 5% de componentes de alto grau: ≥ 5% são classificados como carcinoma urotelial de alto grau, e <5% devem ser relatados como de baixo grau com < 5% de componentes de alto grau. Este último apresenta prognóstico semelhante ao carcinoma urotelial puro de baixo grau não invasivo (WHO 2022; Reis et al., 2016). A GUPS sugeriu recentemente um ponto de corte de 10% (Amin et al. 2021). Recomendamos o diagnóstico de carcinoma urotelial papilífero de baixo grau não invasivo com componente de alto grau menor (< 5%), quando aplicável, com um comentário apropriado sobre os dados limitados disponíveis e o provável prognóstico semelhante aos tumores de baixo grau. Esta abordagem é mais precisa do que o uso de carcinoma urotelial genérico de grau misto. Para carcinomas uroteliais papilares não invasivos com >5% de componente de alto grau, o relato no laudo da quantificação dos componentes de alto grau é opcional.
Referências:
Amin MB, Comperat E, Epstein JI, True LD, Hansel D, Paner GP, Al-Ahmadie H, Baydar D, Bivalacqua T, Brimo F, Cheng L, Cheville J, Dalbagni G, Falzarano S, Gordetsky J, Guo CC, Gupta S, Hes O, Iyer G, Kaushal S, Kunju L, Magi-Galluzzi C, Matoso A, Netto G, Osunkoya AO, Pan CC, Pivovarcikova K, Raspollini MR, Reis H, Rosenberg J, Roupret M, Shah RB, Shariat S, Trpkov K, Weyerer V, Zhou M, McKenney J, Reuter VE (2021) The Genitourinary Pathology Society Update on Classification and Grading of Flat and Papillary Urothelial Neoplasia With New Reporting Recommendations and Approach to Lesions With Mixed and Early Patterns of Neoplasia. Adv Anat Pathol 28:179-195.
Bobjer J, Hagberg O, Aljabery F, Gårdmark T, Jahnson S, Jerlström T, Sherif A, Simoulis A, Ströck V, Häggström C, Holmberg L, Liedberg F (2022) Bladder cancer recurrence in papillary urothelial neoplasm of low malignant potential (PUNLMP) compared to G1 WHO 1999: a population-based study. Scand J Urol 56:14-18.
Hentschel AE, van Rhijn BWG, Bründl J, Compérat EM, Plass K, Rodríguez O, Henríquez JDS, Hernández V, de la Peña E, Alemany I, Turturica D, Pisano F, Soria F, Čapoun O, Bauerová L, Pešl M, Bruins HM, Runneboom W, Herdegen S, Breyer J, Brisuda A, Scavarda-Lamberti A, Calatrava A, Rubio-Briones J, Seles M, Mannweiler S, Bosschieter J, Kusuma VRM, Ashabere D, Huebner N, Cotte J, Mertens LS, Cohen D, Lunelli L, Cussenot O, Sheikh SE, Volanis D, Coté JF, Rouprêt M, Haitel A, Shariat SF, Mostafid AH, Nieuwenhuijzen JA, Zigeuner R, Dominguez-Escrig JL, Hacek J, Zlotta AR, Burger M, Evert M, Hulsbergen-van de Kaa CA, van der Heijden AG, Kiemeney LALM, Soukup V, Molinaro L, Gontero P, Llorente C, Algaba F, Palou J, N’Dow J, Babjuk M, van der Kwast TH, Sylvester RJ (2020) Papillary urothelial neoplasm of low malignant potential (PUN-LMP): Still a meaningful histo-pathological grade category for Ta, noninvasive bladder tumors in 2019? Urol Oncol. 38:440-448.
Pan CC, Chang YH, Chen KK, Yu HJ, Sun CH, Ho DM (2010) Prognostic significance of the 2004 WHO/ISUP classification for prediction of recurrence, progression, and cancer-specific mortality of non-muscle-invasive urothelial tumors of the urinary bladder: a clinicopathologic study of 1,515 cases. Am J Clin Pathol 133:788-795.
Maxwell JP, Wang C, Wiebe N, Yilmaz A, Trpkov K (2015) Long-term outcome of primary Papillary Urothelial Neoplasm of Low Malignant Potential (PUNLMP) including PUNLMP with inverted growth. Diagn Pathol 13;10:3.
Reis LO, Taheri D, Chaux A, Guner G, Mendoza Rodriguez MA, Bivalacqua TJ, Schoenberg MP, Epstein JI, Netto GJ (2016) Significance of a minor high-grade component in a low-grade noninvasive papillary urothelial carcinoma of the bladder. Hum Pathol 47:20-25.
Schultz L (2018) The papilla as a biomarker in the molecular era of bladder oncology. Surg Exp Pathol 1, 10.
WHO Classification of Tumours Editorial Board. Urinary and male genital tumors [Internet]. Lyon (France): International Agency for Research on Cancer; 2022 (WHO classification of tumors series, 5th ed.; vol. 8). Available from: https://tumourclassification.iarc.who.int/chapters/36.
Nota 3
É importante a identificação de diferenciação divergente e subtipos histológicos no carcinoma urotelial invasivo. Esta identificação tem valor prognóstico em alguns casos, e o reconhecimento de algumas morfologias é importante para o diagnóstico diferencial com lesões benignas ou outras neoplasias não uroteliais. A inclusão destes diferentes padrões no laudo poderá – a partir de estudos subsequentes – progressivamente aumentar nosso conhecimento sobre a biologia de cada um deles.
A classificação da OMS 2022 mudou recentemente a terminologia da morfologia variante para subtipo. A presença de qualquer diferenciação divergente e subtipos deve ser relatada e quantificada quanto à porcentagem do componente invasivo. O reconhecimento dos subtipos é essencial para o diagnóstico diferencial adequado com outras lesões (algumas delas mimetizadoras benignas) e, embora não haja dados suficientes para cada subtipo, todas elas são geralmente consideradas agressivas e levam tumores T1 ao mesmo grupo de alto risco (NCCN 2022).
Diretrizes específicas sugeriram cistectomia precoce (para doença pT1) quando há um componente de subtipos micropapilar (Horwich et al. 2019) ou plasmocitóide (Warrick et al. 2020).
A classificação da OMS 2022 lista as seguintes diferenciações divergentes:
- escamosa: células tumorais com pontes intercelulares e queratinização
- glandular: diferenciação em glândulas reais, mais comumente do tipo intestinal
- trofoblástica: células sinciciotrofoblásticas e citotrofoblásticas
- mülleriano: morfologia de adenocarcinoma de células claras tipo mulleriano.
A lista de subtipos da OMS 2022 é:
- em ninhos: pequenos ninhos de formato redondo ou oval com histologia branda, sem atipias nucleares marcantes, que podem imitar ninhos de von Brunn.
- em grandes ninhos: ninhos médios a grandes com núcleos sem atipias. A distinção do crescimento endofítico não invasivo baseia-se principalmente na invasão da muscular própria.
- tubulares e microcístico: células citologicamente brandas que revestem pequenas estruturas tubulares ou microcísticas. A distinção de cistite cística depende do reconhecimento da invasão da camada muscular própria.
- micropapilar: pequenos aglomerados de células tumorais sem eixos fibrovasculares, espaços lacunares com vários grupos epiteliais (o que ajuda a distinguir de aretfato de retração ou invasão angiolinfática) e formação de anéis (luzes no interior destes grupos epiteliais).
- linfoepitelioma-símile: maciços de células indiferenciadas com aparência sincicial entremeadas por um denso infiltrado de linfócitos e outras células inflamatórias.
- plasmocitoide: células infiltrantes únicas com ou sem lúmen citoplasmático ou vacúolos
- sarcomatoide: células fusiformes atípicas e/ou diferenciação heteróloga associada em tipos específicos de sarcoma.
- de células gigantes: células tumorais gigantes pleomórficas bizarras que devem ser distinguidas das células gigantes trofoblásticas e osteoclásticas.
- pouco diferenciados: células tumorais sem características morfológicas que apontem para origem urotelial. Este subtipo inclui um padrão rico em células semelhantes a osteoclastos.
- rico em lipídios: células lipoblásticas com um ou mais vacúolos citoplasmáticos recuando seus núcleos.
- células claras (ricas em glicogênio): acúmulo de glicogênio no interior das células tumorais, resultando em aparência celular transparente. As células claras são positivas à coloração pelo PAS.
Alguns tumores que mostram morfologia escamosa, glandular ou sarcomatoide extensa podem apresentar confusão diagnóstica com carcinoma escamoso puro, adenocarcinoma e sarcomas primários ou metastáticos. Em espécimes de RTU um carcinoma invasivo com extensa diferenciação escamosa deve ser relatado como tal, com um comentário sobre a limitação de se fazer o diagnóstico adequado neste tipo de amostra. Via de regra, a presença de carcinoma urotelial in situ ou carcinoma papilífero urotelial favorece a origem urotelial. Em contraste, extensa metaplasia escamosa e displasia da superfície mucosa podem favorecer (em um comentário) o diagnóstico de carcinoma escamoso puro. O mesmo ocorre com tumores com extensa diferenciação glandular, com adenoma glandular viloso ou adenocarcinoma in situ como lesão precursora favorecendo o adenocarcinoma. No entanto, o adenocarcinoma metastático pode colonizar a superfície mucosa simulando uma forma in situ precursora. Portanto, a história clínica é crucial no diagnóstico diferencial. Em uma proliferação fusiforme atípica, o carcinoma urotelial in situ, o carcinoma papilífero urotelial (coexistente ou previamente ressecado) e a expressão de citoqueratinas permitem o diagnóstico de carcinoma urotelial do subtipo sarcomatoide.
O carcinoma neuroendócrino de pequenas células tem sido historicamente considerado uma diferenciação divergente do carcinoma urotelial. No entanto, na prática atual, qualquer quantidade de carcinoma neuroendócrino em um tumor com predomínio de carcinoma urotelial classificará esta neoplasia como não urotelial e será tratada como um carcinoma neuroendócrino. Por este motivo, o carcinoma neuroendócrino deve ser relatado como o diagnóstico principal ou com igual importância ao carcinoma urotelial. Eles não devem ser listados apenas como um item de diferenciação divergente dentro de um carcinoma urotelial.
Referências:
Horwich A, Babjuk M, Bellmunt J, Bruins HM, De Reijke TM, De Santis M, Gillessen S, James N, Maclennan S, Palou J, Powles T, Ribal MJ, Shariat SF, Van Der Kwast T, Xylinas E, Agarwal N, Arends T, Bamias A, Birtle A, Black PC, Bochner BH, Bolla M, Boormans JL, Bossi A, Briganti A, Brummelhuis I, Burger M, Castellano D, Cathomas R, Chiti A, Choudhury A, Compérat E, Crabb S, Culine S, De Bari B, DeBlok W, De Visschere PJL, Decaestecker K, Dimitropoulos K, Dominguez-Escrig JL, Fanti S, Fonteyne V, Frydenberg M, Futterer JJ, Gakis G, Geavlete B, Gontero P, Grubmüller B, Hafeez S, Hansel DE, Hartmann A, Hayne D, Henry AM, Hernandez V, Herr H, Herrmann K, Hoskin P, Huguet J, Jereczek-Fossa BA, Jones R, Kamat AM, Khoo V, Kiltie AE, Krege S, Ladoire S, Lara PC, Leliveld A, Linares-Espinós E, Løgager V, Lorch A, Loriot Y, Meijer R, Carmen Mir M, Moschini M, Mostafid H, Müller AC, Müller CR, N’Dow J, Necchi A, Neuzillet Y, Oddens JR, Oldenburg J, Osanto S, Oyen WJG, Pacheco-Figueiredo L, Pappot H, Patel MI, Pieters BR, Plass K, Remzi M, Retz M, Richenberg J, Rink M, Roghmann F, Rosenberg JE, Rouprêt M, Rouvière O, Salembier C, Salminen A, Sargos P, Sengupta S, Sherif A, Smeenk RJ, Smits A, Stenzl A, Thalmann GN, Tombal B, Turkbey B, Vahr Lauridsen S, Valdagni R, Van Der Heijden AG, Van Poppel H, Vartolomei MD, Veskimäe E, Vilaseca A, Vives Rivera FA, Wiegel T, Wiklund P, Williams A, Zigeuner R, Witjes JA (2019) EAU-ESMO consensus statements on the management of advanced and variant bladder cancer-an international collaborative multi-stakeholder effort: under the auspices of the EAU and ESMO Guidelines Committees†. Ann Oncol 30:1697-1727.
NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Guidelines Version 2.2022 Bladder Cancer
WHO Classification of Tumours Editorial Board. Urinary and male genital tumors [Internet]. Lyon (France): International Agency for Research on Cancer; 2022 (WHO classification of tumors series, 5th ed.; vol. 8). Available from: https://tumourclassification.iarc.who.int/chapters/36.
Nota 4
A gradação histológica do componente invasivo é controversa e de importância provavelmente limitada. A classificação OMS 2022 ainda endossa a graduação do carcinoma urotelial invasivo, embora muitos autores acreditem que não haja implicação prognóstica na graduação do componente invasivo. Muitos autores defendem que o carcinoma urotelial invasivo deve ser classificado como de alto grau, independentemente da profundidade de invasão. (Amin et al. 2015). Em uma série de 41 pacientes com a doença não músculo-invasiva, taxas de recorrência (34%) e progressão de estágio (7%) (Toll e Epstein 2012). A Genitourinary Pathology Society (GUPS) recomenda que o diagnóstico de carcinoma urotelial invasivo de baixo grau seja seguido de um comentário de que o grau provavelmente não afeta o resultado nesse cenário (Amin et al. 2021). Alguns subtipos de carcinoma urotelial invasivo são típicos de características nucleares de baixo grau, como os subtipos em ninhos, em grandes ninhos, e tubular/microcístico. O prognóstico é semelhante ao carcinoma urotelial invasivo de alto grau (Beltran et al. 2014; Wasco et al., 2010; Miyake et al., 2021). Estes tumores não devem ser designados como de baixo grau. Para o carcinoma urotelial invasivo, atenção especial deve ser direcionada à diferenciação e subtipos divergentes, visto que – na prática – quase todos serão graduados como de alto grau histológico.
Em resumo, as mensagens mais importantes neste assunto são:
- um comentário pode ser feito sobre os dados limitados sobre as implicações prognósticas do carcinoma urotelial invasivo de baixo grau.
- o carcinoma urotelial invasivo de baixo grau deve ser um diagnóstico raro. É incomum e deve ser separado de subtipos agressivos com morfologia branda
- alguns subtipos citologicamente brandos, como em ninhos, em grandes ninhos e tubulares/microcístico são clinicamente agressivos. A presença de subtipos deve ser mencionada e quantificada e, nesses casos, um grau não deve ser atribuído (ou relatado como “não aplicável”).
Referências:
Amin MB, Smith SC, Reuter VE, Epstein JI, Grignon DJ, Hansel DE, Lin O, McKenney JK, Montironi R, Paner GP, Al-Ahmadie HA, Algaba F, Ali S, Alvarado-Cabrero I, Bubendorf L, Cheng L, Cheville JC, Kristiansen G, Cote RJ, Delahunt B, Eble JN, Genega EM, Gulmann C, Hartmann A, Langner C, Lopez-Beltran A, Magi-Galluzzi C, Merce J, Netto GJ, Oliva E, Rao P, Ro JY, Srigley JR, Tickoo SK, Tsuzuki T, Umar SA, Van der Kwast T, Young RH, Soloway MS (2015) Update for the practicing pathologist: The International Consultation On Urologic Disease-European association of urology consultation on bladder cancer. Mod Pathol 28:612-30.
Amin MB, Comperat E, Epstein JI, True LD, Hansel D, Paner GP, Al-Ahmadie H, Baydar D, Bivalacqua T, Brimo F, Cheng L, Cheville J, Dalbagni G, Falzarano S, Gordetsky J, Guo CC, Gupta S, Hes O, Iyer G, Kaushal S, Kunju L, Magi-Galluzzi C, Matoso A, Netto G, Osunkoya AO, Pan CC, Pivovarcikova K, Raspollini MR, Reis H, Rosenberg J, Roupret M, Shah RB, Shariat S, Trpkov K, Weyerer V, Zhou M, McKenney J, Reuter VE (2021) The Genitourinary Pathology Society Update on Classification and Grading of Flat and Papillary Urothelial Neoplasia With New Reporting Recommendations and Approach to Lesions With Mixed and Early Patterns of Neoplasia. Adv Anat Pathol 28:179-195.
Beltran AL, Cheng L, Montironi R, Blanca A, Leva M, Rouprêt M, Fonseca J, Vidal A, Menendez CL, Pallares J, Bollito E, Reymundo C, Luque RJ, Comperat E (2014) Clinicopathological characteristics and outcome of nested carcinoma of the urinary bladder. Virchows Arch 465:199-205.
Miyake M, Nishimura N, Iida K, Fujii T, Nishikawa R, Teraoka S, Takenaka A, Kikuchi H, Abe T, Shinohara N, Okajima E, Shimizu T, Hori S, Tsuchiya N, Owari T, Murakami Y, Taoka R, Kobayashi T, Kojima T, Nishiyama N, Kitamura H, Nishiyama H, Fujimoto K (2021) Intravesical Bacillus Calmette-Guérin Treatment for T1 High-Grade Non-Muscle Invasive Bladder Cancer with Divergent Differentiation or Variant Morphologies. Cancers (Basel) 13:2615.
Toll AD, Epstein JI (2012) Invasive low-grade papillary urothelial carcinoma: a clinicopathologic analysis of 41 cases. Am J Surg Pathol 36:1081–1086.
Wasco MJ, Daignault S, Bradley D, Shah RB (2010) Nested variant of urothelial carcinoma: a clinicopathologic and immunohistochemical study of 30 pure and mixed cases. Hum Pathol 41:163–71.
WHO Classification of Tumours Editorial Board. Urinary and male genital tumors [Internet]. Lyon (France): International Agency for Research on Cancer; 2022 (WHO classification of tumors series, 5th ed.; vol. 8). Available from: https://tumourclassification.iarc.who.int/chapters/36.
Nota 5
O diagnóstico do papiloma urotelial invertido requer nenhum ou mínimo crescimento exofítico (WHO 2022). Não há critérios definitivos (como porcentagem mínima de crescimento endofítico) para designar o carcinoma urotelial papilífero de baixo ou alto grau como “subtipo invertido”. A GUPS sugere um ponto de corte de 80% para diagnosticar qualquer neoplasia urotelial papilar como invertida (Amin et al. 2021). Tumores com padrão de crescimento invertido podem aparecer predominantemente endofíticos ou nodulares, com superfície lisa. Consequentemente, relatar qualquer quantidade de crescimento endofítico/invertido pode ser de interesse para correlação com os achados da cistoscopia. Assim, recomendamos dentro de um item de “configuração tumoral” descrever padrões de crescimento de uma neoplasia urotelial não invasiva como “exofítico, com menor crescimento endofítico” quando aplicável.
Referências:
Amin MB, Comperat E, Epstein JI, True LD, Hansel D, Paner GP, Al-Ahmadie H, Baydar D, Bivalacqua T, Brimo F, Cheng L, Cheville J, Dalbagni G, Falzarano S, Gordetsky J, Guo CC, Gupta S, Hes O, Iyer G, Kaushal S, Kunju L, Magi-Galluzzi C, Matoso A, Netto G, Osunkoya AO, Pan CC, Pivovarcikova K, Raspollini MR, Reis H, Rosenberg J, Roupret M, Shah RB, Shariat S, Trpkov K, Weyerer V, Zhou M, McKenney J, Reuter VE (2021) The Genitourinary Pathology Society Update on Classification and Grading of Flat and Papillary Urothelial Neoplasia With New Reporting Recommendations and Approach to Lesions With Mixed and Early Patterns of Neoplasia. Adv Anat Pathol 28:179-195.
WHO Classification of Tumours Editorial Board. Urinary and male genital tumors [Internet]. Lyon (France): International Agency for Research on Cancer; 2022 (WHO classification of tumors series, 5th ed.; vol. 8). Available from: https://tumourclassification.iarc.who.int/chapters/36.
Nota 6
O estadiamento e subestadiamento tem diferentes abordagens em produtos de RTU e em peças de cistectomia. O estadiamento patológico stricto sensu aplica-se apenas às cistectomias parciais ou radicais (AJCC 2017). O College of American Pathologists não recomenda a designação de uma categoria de pT em um espécime RTU devido às altas taxas de discrepância em espécimes subsequentes de cistectomia. Em um estudo, uma mudança da “doença pT1” (invasão da lâmina própria) na RTU para um estágio mais alto na cistectomia ocorreu em 48–50% dos casos, sendo 33% não confinados a órgãos (pT3 ou linfonodos positivos) (Paner et al. 2017).
A maioria dos pacientes, no entanto, não é submetida à cistectomia, e o estadiamento do tumor para manejo clínico dependerá principalmente do laudo anatomopatológico de uma amostra de RTU. Essa é uma das razões pelas quais, em alguns centros, os patologistas relatam uma categoria “pT” em espécimes RTU. No entanto, a avaliação de uma categoria precisa de “pT” em espécimes RTU é fortemente dependente da informação sobre se o material obtido consiste numa uma ressecção completa ou não.
Portanto, o estadiamento pT em espécimes RTU pode ser opcional e, se relatado, um comentário explicando as ressalvas de fazê-lo em tal espécime deve ser incluído. O laudo anatomopatológico deve indicar claramente a profundidade da invasão, ou seja, o diagnóstico de carcinoma invasivo deve explicitar a extensão da doença à lâmina própria ou a camada muscular própria.
A invasão tumoral no tecido adiposo e estroma prostático deve ser relatada, mas requer um comentário, conforme detalhado abaixo. Os espécimes de RTU têm uma inerente falta de orientação que limita a avaliação precisa da profundidade de invasão da lâmina própria. Mesmo que difícil em alguns casos, recomenda-se “subestadiar pT1” com os seguintes itens (ver figura 2):
- áreas unifocais ou multifocais de invasão
- invasão do pedúnculo da papila versus base do tumor papilar
- avaliação micrométrica da maior área invasiva (diâmetro ou profundidade máxima) com tamanho de corte de 0,5 mm ou 1 mm, geralmente considerado de importância prognóstica.
Em uma experiência de um único centro de 64 pacientes com doença T1, as taxas de progressão (definida como upstage ou metástases) foram 0 para invasão somente do eixo das papilas, 25% para invasão de base ≤ 1mm a e 62% para invasão de base > 1 mm (em foco ou agregado em mais de um) (Lawless et al. 2017). O ponto de corte de 1 mm também se mostrou de importância prognóstica (Colombo et al. 2018). Outros relatos sugerem o valor prognóstico do tamanho de corte de um campo de alta potência (~0,5 mm na maioria dos microscópios) (van Rhijn et al. 2012). Esse ponto de corte foi validado em um estudo multicêntrico envolvendo 601 pacientes T1 e provou predizer a progressão e a sobrevida específica para câncer. No seguimento de 5 anos, as taxas de progressão foram de 10,1% e 34,5% para lesões < 0,5 mm e ≥ 0,5 mm, respectivamente. No mesmo período de acompanhamento, as taxas de sobrevida específicas para câncer foram de 93% e 79% para lesões < 0,5 mm e ≥ 0,5 mm, respectivamente (Fransen van de Putte et al. 2018). Um estudo adicional também sugeriu o ponto de corte de 2,3 mm no comprimento linear agregado do carcinoma invasivo (usando a soma de todos os focos invasivos) (Leivo et al. 2018).

Figura 2. Focos invasivos dentro de um carcinoma urotelial papilífero podem ser vistos no eixo fibrovascular das papilas, o que é um achado incomum (à esquerda) ou na base da lesão (borda profunda do componente não invasivo de um carcinoma urotelial papilífero (no centro e à esquerda) – que podem ter tamanho limitado ou maior extensão. Os pontos de cortes mais utilizados são 0,5 mm e 1 mm no maior foco invasivo ou na medida agregada do componente invasivo. Pequenos focos de invasão somente com pedúnculo mostram melhor prognóstico.
Alguns autores sugerem, e algumas diretrizes citam, o método alternativo de subestadiamento histoanatômico baseado na localização da profundidade de invasão tumoral como superficial ou profunda (submucosa) usando a camada muscular da mucosa como limite de referência. Não é prático na prática diária, pois a camada muscular da mucosa vesical é irregular e descontínua, podendo estar ausente em algumas regiões vesicais – tais como no trígono (Paner et al. 2007). Grandes vasos da lâmina própria têm sido defendidos como referência alternativa quando não há fibras musculares lisas na lâmina própria (Magers et al. 2019). Até que novas evidências estejam disponíveis, recomendamos a estratificação da invasão da lâmina própria nos três parâmetros listados acima (focalidade, localização e tamanho). Uma boa comunicação é importante em uma equipe multidisciplinar para que todos os envolvidos entendam as diferenças na estimativa do tamanho de uma invasão. Até que não esteja definido em diretrizes ou novos protocolos de estadiamento, é aceitável utilizar ambos os tamanhos de corte de 0,5 mm e 1,0 mm. O tamanho do componente invasivo deve ser declarado como estimado no foco maior ou como uma estimativa agregada de todos os focos invasivos. O primeiro é mais fácil de avaliar e é a base da maioria dos estudos no subestadiamento T1 do câncer de bexiga.
A invasão da camada muscular própria é uma informação prognóstica crucial. Em pacientes com documentação histológica de invasão desta camada, os exames de imagem frequentemente mostram invasão de partes moles perivesicais ou próstata, o que seria indicativo de estágios mais elevados. Por este motivo, é importante explicar aos urologistas e oncologistas que o achado de carcinoma urotelial invasivo em meio à camada muscular própria não é sinônimo de doença em estágio pT2. A melhor abordagem é comentar que a invasão da camada muscular própria em um espécime RTU indica o “estágio pT2 no mínimo”, uma vez que este tipo de espécime é limitado a avaliar estágios superiores. Ver discussão abaixo.
A invasão do tecido adiposo não é igual à doença pT3 em um espécime de RTU. O tecido adiposo é um achado normal na lâmina própria, entre os feixes musculares espessos da muscular própria e no tecido perivesical (Philip et al. 2000). A invasão de um pequeno fragmento desorientado de tecido adiposo pode ser relatada e comentada à luz da informação acima. A correlação com exames de imagem deve ser recomendada.
A invasão do estroma prostático não é igual à doença pT4 em um espécime RTU. Essa observação pode refletir a invasão direta do carcinoma de bexiga para a próstata (pT4 verdadeiro para um tumor primário de bexiga). No entanto, o carcinoma urotelial é comumente multifocal na mucosa vesical e em todo o trato urinário. Portanto, uma avaliação patológica de um espécime RTU não pode distinguir invasão direta da bexiga para prostrada para o cenário de dois tumores independentes (um primário vesical de qualquer estágio, um carcinoma urotelial pT2 de uretra prostática como sítio primário). A invasão do estroma prostático qualifica-se para pT2 no caso de tumor primário da uretra prostática e quando há uma extensão de um carcinoma in situ da bexiga para a uretra prostática com a invasão do estroma prostático. A invasão do estroma prostático pode ser relatada e comentada à luz destas observações (Paner et al. 2017). A correlação com exames de imagem deve ser recomendada.
Referências:
American Joint Committee on Cancer (AJCC). Cancer Staging Manual. 8th Edition, 2017.
Colombo R, Hurle R, Moschini M, Freschi M, Colombo P, Colecchia M, Ferrari L, Lucianò R, Conti G, Magnani T, Capogrosso P, Conti A, Pasini L, Burgio G, Guazzoni G, Patriarca C (2018) Feasibility and Clinical Roles of Different Substaging Systems at First and Second Transurethral Resection in Patients with T1 High-Grade Bladder Cancer. Eur Urol Focus 4(1):87-93.
Fransen van de Putte EE, Otto W, Hartmann A, Bertz S, Mayr R, Bründl J, Breyer J, Manach Q, Compérat EM, Boormans JL, Bosschieter J, Jewett MAS, Stoehr R, van Leenders GJLH, Nieuwenhuijzen JA, Zlotta AR, Hendricksen K, Rouprêt M, Burger M, van der Kwast TH, van Rhijn BWG (2018) Metric substage according to micro and extensive lamina propria invasion improves prognostics in T1 bladder cancer. Urol Oncol 36(8):361.e7-361.e13.
Lawless M, Gulati R, Tretiakova M (2017) Stalk versus base invasion in pT1 papillary cancers of the bladder: improved substaging system predicting the risk of progression. Histopathology 71:406-414.
Leivo MZ, Sahoo D, Hamilton Z, Mirsadraei L, Shabaik A, Parsons JK, Kader AK, Derweesh I, Kane C, Hansel DE (2018) Analysis of T1 Bladder Cancer on Biopsy and Transurethral Resection Specimens: Comparison and Ranking of T1 Quantification Approaches to Predict Progression to Muscularis Propria Invasion. Am J Surg Pathol 42(1):e1-e10.
Magers MJ, Lopez-Beltran A, Montironi R, Williamson SR, Kaimakliotis HZ, Cheng L (2019) Staging of bladder cancer. Histopathology 74:112-134.
Paner GP, Ro JY, Wojcik EM, Venkataraman G, Datta MW, Amin MB (2007) Further characterization of the muscle layers and lamina propria of the urinary bladder by systematic histologic mapping: implications for pathologic staging of invasive urothelial carcinoma. Am J Surg Pathol 31:1420-1429.
Paner GP, Montironi R, Amin MB (2017) Challenges in pathologic staging of bladder Cancer: proposals for fresh approaches of assessing pathologic stage in light of recent studies and observations pertaining to bladder Histoanatomic variances. Adv Anat Pathol 24:113–127
Philip AT, Amin MB, Tamboli P, Lee TJ, Hill CE, Ro JY (2000) Intravesical adipose tissue: a quantitative study of its presence and location with implications for therapy and prognosis. Am J Surg Pathol 24(9):1286–1290
Van Rhijn BW, van der Kwast TH, Alkhateeb SS, Fleshner NE, van Leenders GJ, Bostrom PJ, van der Aa MN, Kakiashvili DM, Bangma CH, Jewett MA, Zlotta AR (2012) A new and highly prognostic system to discern T1 bladder cancer substage. Eur Urol 61(2):378-84.
Nota 7
A invasão do estroma prostático não é igual à doença pT4 em um espécime RTU. Essa observação pode refletir a invasão direta do carcinoma de bexiga para a próstata (pT4 verdadeiro para um tumor primário de bexiga). No entanto, o carcinoma urotelial é comumente multifocal na mucosa vesical e em todo o trato urinário. Portanto, uma avaliação patológica de um espécime RTU não pode distinguir invasão direta da bexiga para prostrada para o cenário de dois tumores independentes (um primário vesical de qualquer estágio, um carcinoma urotelial pT2 de uretra prostática como sítio primário). A invasão do estroma prostático qualifica-se para pT2 no caso de tumor primário da uretra prostática e quando há uma extensão de um carcinoma in situ da bexiga para a uretra prostática com a invasão do estroma prostático. A invasão do estroma prostático pode ser relatada e comentada à luz destas observações (Paner et al. 2017). A correlação com exames de imagem deve ser recomendada.
Referências:
Paner GP, Montironi R, Amin MB (2017) Challenges in pathologic staging of bladder Cancer: proposals for fresh approaches of assessing pathologic stage in light of recent studies and observations pertaining to bladder Histoanatomic variances. Adv Anat Pathol 24:113–127
Nota 8
A invasão linfovascular (IVL) deve ser relatada em todos os casos de carcinoma invasivo. O IVF é um preditor independente de recorrência e diminuição da sobrevida global (Streeper al.t al., 2009). A presença de IVE em espécimes de RTU tem boa concordância com IVE em espécimes de cistectomia subsequentes e está associada a metástases linfonodais em quase 40% dos casos (Kunju et al., 2008). A presença de LVI na maioria dos casos pode ser estabelecida apenas com base na morfologia e uso da coloração de rotina. Entretanto, a imuno-histoquímica para marcadores endoteliais (D2-40, CD31, CD34, ERG) pode auxiliar na identificação de IVL em casos desafiadores. Deve-se tomar cuidado para não sobreinterpretar artefatos de retração como LVI. O carcinoma urotelial superficialmente invasivo comumente exibe artefatos de retração ao redor de pequenos ninhos irregulares invadindo a lâmina própria. Achado semelhante também é observado em muito maior extensão no subtipo micropapilar do carcinoma urotelial invasivo, no qual múltiplos ninhos de células uroteliais neoplásicas são vistos flutuando dentro de um espaço. Portanto, critérios morfológicos rigorosos devem ser usados para evitar erros de interpretação ou artefatos de retração como LVI nos cenários acima. Os critérios morfológicos sugeridos por Algaba em 2006 incluem tumores fortemente coesos com borda lisa e células periféricas achatadas, trombo tumoral completamente flutuante/descolado, revestimento endotelial inequívoco, presença de fibrina e hemácias ao redor do trombo, proximidade de arteríola e estroma normal ao redor (Algaba, 2006).
Referências:
Algaba F (2006) Lymphovascular invasion as a prognostic tool for advanced bladder cancer. Curr Opin Urol: 16(5):367-371.
Kunju LP, You L, Zhang Y, Daignault S, Montie JE, Lee CT (2008) Lymphovascular invasion of urothelial cancer in matched transurethral bladder tumor resection and radical cystectomy specimens. J Urol: 180(5):1928-1932; discussion 1932.
Streeper NM, Simons CM, Konety BR, Muirhead DM, Williams RD, O’Donnell MA, Joudi FN (2009) The significance of lymphovascular invasion in transurethral resection of bladder tumor and cystectomy specimens on the survival of patients with urothelial bladder cancer. BJU Int: 103(4):475-479.
Nota 9
O laudo anatomopatológico deve indicar claramente a presença da camada muscular própria (músculo detrusor). E, se presente, o laudo deve explicitar se esta camada está livre de tumor ou infiltrada por este. Os patologistas devem evitar termos ambíguos como “carcinoma urotelial envolvendo fibras musculares lisas”. Se não for possível definir a presença da camada muscular própria, o patologista deve indicar claramente essa limitação relatando “invasão indefinida para muscularis propria”. Em casos selecionados, a imuno-histoquímica para desmina pode ser útil para identificar invasão muscular própria em grandes tumores invasivos com padrões destrutivos de invasão e reações desmoplásicas. O uso de smoothelin não é recomendado (Amin et al. 2014).
Para tumores invasivos de grande porte com reação estromal desmoplásica, pode-se comentar a ausência da camada muscular própria identificável que pode ser devida à invasão destrutiva e que, nesse cenário, é importante a correlação da profundidade de invasão documentada em exames de imagem. Atenção especial deve ser dada à camada muscular própria hiperplásica, que pode ser confundida com a camada muscular própria. A camada muscular própria verdadeira localiza-se profundamente, abaixo dos grandes vasos da lâmina própria, e mostra feixes grandes, espessos e compactos de fibras musculares lisas (figura 3).
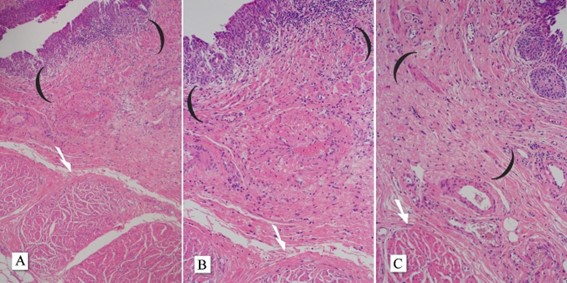
Figura 3: A mucosa vesical com o tecido conjuntivo frouxo da lâmina própria é geralmente a camada mais espessa da bexiga. A camada muscular da mucosa é geralmente um grupo descontínuo de fibras musculares finas e lisas localizado dentro da lâmina própria. Atenção especial deve ser dada à muscular própria hiperplásica, que pode ser confundida com muscular própria. As fibras musculares lisas da mucosa muscular são vistas dentro do estroma frouxo da lâmina própria e ocasionalmente podem parecer hiperplásicas (entre parênteses). A camada muscular própria verdadeira está localizada profundamente, abaixo dos grandes vasos da lâmina própria. A muscular própria mostra feixes grandes, espessos e compactos de fibras musculares lisas (setas).
A ausência de amostragem da camada muscular própria na primeira tentativa de ressecção transuretral é um fator importante na decisão de uma nova RTU. A documentação da invasão da camada muscular própria é informação crucial do estadiamento que indicará a cistectomia radical na maioria dos casos e, quando esta abordagem não for possível, a terapia trimodal (RTU, radioterapia e quimioterapia). Em casos selecionados, cortes mais profundos dos bloqueios histológicos podem ajudar a identificar a muscular própria ou sua invasão.
Referências:
Amin MB, Trpkov K, Lopez-Beltran A, Grignon D; Members of the ISUP Immunohistochemistry in Diagnostic Urologic Pathology Group (2014) Best practices recommendations in the application of immunohistochemistry in the bladder lesions: report from the International Society of Urologic Pathology consensus conference. Am J Surg Pathol 38:e20-34.
Amin MB, Edge SB, Greene FL, et al., eds (2017) AJCC Cancer Staging Manual. 8th ed. New York: Springer.
Paner GP, Ro JY, Wojcik EM, Venkataraman G, Datta MW, Amin MB (2007) Further characterization of the muscle layers and lamina propria of the urinary bladder by systematic histologic mapping: implications for pathologic staging of invasive urothelial carcinoma. Am J Surg Pathol 31:1420-1429.
Nota 10
O diagnóstico de carcinoma urotelial in situ associado a carcinoma urotelial papilífero é controverso. A classificação da OMS de 2022 afirma que o carcinoma urotelial in situ é raro (apenas 1-3% são diagnosticados de novo). A maioria dos casos é diagnosticada sincronicamente ou posteriormente ao carcinoma urotelial papilífero de alto grau (carcinoma urotelial in situ secundário). Entretanto, alguns autores recomendam não diagnosticar carcinoma urotelial in situ adjacente a um carcinoma urotelial papilífero de alto grau (que seria uma “lesão do ombro”) ou como uma lesão plana residual no sítio RTU anterior. O manual de laudos da International Collaboration on Cancer Reporting (ICCR) reconhece que não há critérios geralmente aceitos para tomar essa decisão, mas recomenda fazer um diagnóstico de carcinoma urotelial in situ se: houver uma representação de urotélio normal entre o tumor papilar e a lesão plana ou (b) se a morfologia da lesão plana for diferente da do epitélio na superfície das frondes papilares (Varma et al. 2020). Tal distinção é importante para o cuidado do paciente, uma vez que o carcinoma urotelial in situ coexistente colocará um carcinoma urotelial de alto grau em um grupo de alto risco, de acordo com a diretriz da NCCN (NCCN 2022), ou grupo de muito alto risco, de acordo com as diretrizes da Associação Europeia de Urologia (Lobo et al. 2022).
A separação adequada do sítio de RTU ou biópsia prévia no sítio RTU de biópsias aleatórias de mucosa plana resolveria facilmente esse problema na maioria dos casos (Figura 1). É importante, no entanto, ressaltar que os artigos originais que definiram a coexistência do carcinoma urotelial in situ estavam associados a maiores taxas de recidiva e progressão, mas não detalharam como essa coexistência foi avaliada (adjacente ao tumor papilífero versus longe dele) (Sylvester et al. 2006). Não há dados sobre a diferença de prognóstico desses dois diferentes cenários. Até que essas informações não estejam disponíveis, essa distinção será baseada na opinião de especialistas. Os espécimes de RTU são geralmente fragmentados e desorientados, o que impede a avaliação adequada das margens. É razoável inferir que a presença de atipia grave na mucosa plana adjacente derive da extensão do carcinoma papilífero para o epitélio adjacente. De fato, o carcinoma urotelial in situ concomitante demonstrou ter mais semelhanças genéticas com o carcinoma urotelial papilífero de alto grau do que com a assinatura in situ do carcinoma urotelial (Hedegaard et al. 2016). No caso de um espécime claramente referido como apenas um tumor ressecado, o diagnóstico de carcinoma urotelial in situ pode indicar que a doença residual na mucosa não papilar é provável.
Embora nenhuma terminologia alternativa tenha sido proposta para o carcinoma urotelial in situ, muitos autores entendem essa lesão como uma “extensão para a mucosa plana de um carcinoma urotelial papilífero de alto grau”. Tais achados devem ser relatados, pois podem indicar doença residual (extensão para mucosa plana não ressecada, além do que foi visto como tumor papilar durante o procedimento). O diagnóstico de carcinoma urotelial in situ longe da mucosa adjacente dos tumores papilíferos infere cancerização de campo da mucosa vesical, sendo razoável entendê-lo como marcador de maior risco de recidiva e progressão. Novamente, os estudos que sustentam a coexistência do carcinoma urotelial in situ como fator de inserção de neoplasia papilífero em grupos de alto ou muito alto risco não distinguem claramente esses dois cenários.
Informações cistoscópicas e separação das amostras são cruciais para tal distinção (ver Figura 1). Se este não for o caso, o diagnóstico de carcinoma urotelial in situ pode ser feito com um comentário. Por analogia, o diagnóstico de carcinoma urotelial in situ pode ser visto como um carcinoma intraductal da próstata. Um diagnóstico morfológico definido de atipia grave dentro de ductos prostáticos que pode ser uma lesão precursora ou (mais frequentemente) umaa extensão de um carcinoma de alto grau para ductos pré-existentes (Srigley et al. 2022). Em resumo, recomendamos que o laudo anatomopatológico do espécime de RTU tenha sempre um item sobre os achados da mucosa plana adjacente. Atipias graves na mucosa plana devem ser diagnosticadas como carcinoma urotelial in situ. No entanto, a interpretação e os comentários apropriados dependem de cada situação (Figura 1):
- se o urologista rotular o espécime apenas como uma ressecção de um tumor papilífero, o diagnóstico de carcinoma urotelial in situ pode ser feito com um comentário de que é muito provavelmente a extensão de um carcinoma urotelial de alto grau para a mucosa da bexiga plana adjacente e as implicações clínicas ou prognósticas são desconhecidas.
- se o carcinoma urotelial in situ for diagnosticado no local de uma RTU prévia (que pode ser suspeitado por evidência patológica do local da biópsia anterior e confirmado por informações clínicas do urologista), pode-se comentar que esse achado pode ser uma lesão residual (ombro) de uma ressecção prévia de um carcinoma urotelial papilífero de alto grau.
- se tanto um tumor papilífero quanto biópsias de mucosa plana afastadas do tumor macroscópico foram realizadas e submetidas em um único recipiente, o diagnóstico de carcinoma urotelial in situ pode ser feito com um comentário sobre as limitações para distinguir ambas as situações (e a provável interpretação como lesão do ombro versus cancerização de campo). As regras do ICCR podem ser usadas e comentadas, mas os critérios propostos geralmente não serão preenchidos para o diagnóstico de carcinoma urotelial in situ.
- se tanto um tumor papilífero quanto biópsias de mucosa plana afastadas do tumor macroscópico foram realizadas em recipientes diferentes, o diagnóstico de carcinoma urotelial in situ pode ser feito diretamente nas lesões planas enviadas separadamente.
Esta questão destaca a importância de uma boa comunicação entre urologistas e patologistas. Esta distinção nos laudos anatomopatológicos permitirá futuras pesquisas que se necessitem de distinguir claramente a implicação prognóstica do carcinoma urotelial in situ diagnosticados nesses diferentes cenários.
O carcinoma urotelial in situ apresentando de novo é raro. A maioria dos casos é diagnosticada em associação com carcinoma urotelial papilífero, carcinoma urotelial invasivo ou no seguimento de carcinoma urotelial (ver discussão acima). Este diagnóstico requer atipia nuclear marcante, embora não seja necessário mostrar toda a espessura do urotélio. O carcinoma urotelial in situ é uma lesão de alto grau e não é graduada. Alguns urotélios planos podem apresentar atipia nuclear e perda de polaridade que não preenche os critérios para carcinoma in situ. Nesses casos, um diagnóstico de displasia urotelial ou atipia urotelial plana de significado desconhecido pode ser feito. Alguns autores defendem o uso do termo displasia apenas no contexto do acompanhamento do carcinoma urotelial (Amin et al. 2021). A displasia não é graduada. A história clínica é importante nesse cenário. A taxa de progressão para carcinoma é de 14-19% em lesões de novo e 30-36% quando diagnosticadas após carcinoma urotelial previamente ressecado (Cheng et al., 1999; Cheng et al., 2000; Lopez-Beltran et al., 2013).
Em algumas ocasiões, o urotélio de configuração plana pode não apresentar atipia nuclear, mas alterações arquiteturais como hipercelularidade e espessamento (mais de 6-7 núcleos de células uroteliais polarizadas), com ou sem morfologia ondulatória/tenda (sem núcleos fibrovasculares verdadeiros, finos e delicados). Essas lesões foram previamente denominadas hiperplasia urotelial. Em 2016, a classificação da OMS a renomeou para proliferação urotelial de potencial maligno desconhecido (UPUMP) (Moch et al. 2016). Essa seria a contrapartida plana do PUNLMP papilar. No entanto, essa terminologia não ganhou uso generalizado, sendo geralmente vista (e ignorada) como uma lesão do ombro de carcinoma urotelial papilífero de baixo grau. Em raros casos, entretanto, tais lesões são observadas em um cenário de novo. A classificação de tumores da OMS 2022 não abordou a classificação dessas lesões planas.
A GUPS recomendou em 2021 o uso da terminologia de proliferação urotelial plana atípica e proliferação urotelial atípica. Pode ser interpretada como um potencial precursor do carcinoma urotelial papilífero de baixo grau não invasivo ou lesão “ombro”/adjacente/residual de um carcinoma urotelial papilífero de baixo grau não invasivo. Novamente, a história clínica é importante para a avaliação de risco dessas lesões. A taxa de progressão para lesões de novo é estimada em 15%. No entanto, a taxa de progressão para carcinoma após o diagnóstico destas lesões é de até 41% quando há história prévia de carcinoma urotelial. Para UPUMP de novo, a aparência papilar na cistoscopia e a morfologia em tenda (crescimentos papilares) na microscopia foram associadas a uma maior taxa de progressão (Lowenthal et al. 2020). Essas observações servem de base para estratificação tais lesões em planas e tendas. O uso da terminologia hiperplasia urotelial (plana ou papilar), UPUMP e proliferação urotelial atípica (plana ou em tenda) é aceitável, e recomenda-se acrescentar um comentário sobre as taxas de carcinoma urotelial papilífero de baixo grau subsequentes que são influenciadas pela história clínica. Exemplos de comentários úteis estão disponíveis no apêndice deste documento. A vigilância com cistoscopia é aconselhada.
Referências:
Amin MB, Comperat E, Epstein JI, True LD, Hansel D, Paner GP, Al-Ahmadie H, Baydar D, Bivalacqua T, Brimo F, Cheng L, Cheville J, Dalbagni G, Falzarano S, Gordetsky J, Guo CC, Gupta S, Hes O, Iyer G, Kaushal S, Kunju L, Magi-Galluzzi C, Matoso A, Netto G, Osunkoya AO, Pan CC, Pivovarcikova K, Raspollini MR, Reis H, Rosenberg J, Roupret M, Shah RB, Shariat S, Trpkov K, Weyerer V, Zhou M, McKenney J, Reuter VE (2021) The Genitourinary Pathology Society Update on Classification and Grading of Flat and Papillary Urothelial Neoplasia With New Reporting Recommendations and Approach to Lesions With Mixed and Early Patterns of Neoplasia. Adv Anat Pathol 28:179-195.
Hedegaard J, Lamy P, Nordentoft I, Algaba F, Høyer S, Ulhøi BP, Vang S, Reinert T, Hermann GG, Mogensen K, Thomsen MBH, Nielsen MM, Marquez M, Segersten U, Aine M, Höglund M, Birkenkamp-Demtröder K, Fristrup N, Borre M, Hartmann A, Stöhr R, Wach S, Keck B, Seitz AK, Nawroth R, Maurer T, Tulic C, Simic T, Junker K, Horstmann M, Harving N, Petersen AC, Calle ML, Steyerberg EW, Beukers W, van Kessel KEM, Jensen JB, Pedersen JS, Malmström PU, Malats N, Real FX, Zwarthoff EC, Ørntoft TF, Dyrskjøt L (2016) Comprehensive Transcriptional Analysis of Early-Stage Urothelial Carcinoma. Cancer Cell 11;30(1):27-42.
Lobo N, Hensley PJ, Bree KK, Nogueras-Gonzalez GM, Navai N, Dinney CP, Sylvester RJ, Kamat AM (2022) Updated European Association of Urology (EAU) Prognostic Factor Risk Groups Overestimate the Risk of Progression in Patients with Non-muscle-invasive Bladder Cancer Treated with Bacillus Calmette-Guérin. Eur Urol Oncol 5:84-91.
Lopez-Beltran A, Montironi R, Vidal A, Scarpelli M, Cheng L (2013) Urothelial dysplasia of the bladder: diagnostic features and clinical significance. Anal Quant Cytopathol Histpathol 35:121-129.
Moch H, Humphrey PA, Ulbright TM, Reuter V (2016) WHO Classification of Tumours of the Urinary System and Male Genital Organs. Lyon, France: International Agency for Research on Cancer.
NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Guidelines Version 2.2022 Bladder Cancer
Srigley JR, Tsuzuki T, Amin MB, Rubin MA. editors. Intraductal carcinoma of the prostate. In: WHO Classification of Tumours Editorial Board. Urinary and male genital tumours. Lyon (France): International Agency for Research on Cancer; 2022 (WHO classification of tumours series, 5th ed.; vol. 8). https://publications.iarc.fr.
Sylvester RJ, van der Meijden AP, Oosterlinck W, Witjes JA, Bouffioux C, Denis L, Newling DW, Kurth K (2006) Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol. 49:466-5; discussion 475-7.
Varma M, Srigley JR, Brimo F, Compérat E, Delahunt B, Koch M, Lopez-Beltran A, Reuter V, Samaratunga H, Shanks JH, Tsuzuki T, van der Kwast T, Webster F, Grignon D (2020) Dataset for the reporting of urinary tract carcinoma-biopsy and transurethral resection specimen: recommendations from the International Collaboration on Cancer Reporting (ICCR). Mod Pathol 33:700-712.
WHO Classification of Tumours Editorial Board. Urinary and male genital tumors [Internet]. Lyon (France): International Agency for Research on Cancer; 2022 (WHO classification of tumors series, 5th ed.; vol. 8). Available from: https://tumourclassification.iarc.who.int/chapters/36.
Nota 11
A descrição de achados não neoplásicos no laudo anatomopatológico de lesões vesicais suspeitas de neoplasia é importante para correlação clínico-patológica. Os achados podem indicar que o procedimento atingiu o local da biópsia prévia (cicatriz fibrosa, granulomas de corpo estranho, cistite eosinofílica) ou que a amostra apresenta efeitos de terapias prévias (cistite de padrões diferentes, granulomas caseosos por infecção ou instilação prévia de BCG). Novamente aqui, informações sobre terapias anteriores são importantes para a interpretação adequada.
A radioterapia pode induzir atipia nuclear grave em células uroteliais. Em lesões planas, o conhecimento da exposição prévia à radiação e do tempo de atuação é importante para a interpretação da lesão pelos patologistas. Há uma sobreposição significativa entre carcinoma urotelial in situ e alterações relacionadas ao efeito da radiação, e essa distinção não deve ser feita dentro de 12 meses após a radioterapia (Epstein e Netto 2014). Ao realizar uma biópsia em uma área irradiada recentemente, é importante remover o tecido distrófico antes de realizar as biópsias.
Algumas lesões de mucosa elevada ou aparência polipoide podem ser causadas por adenoma nefrogênico, cistite glandular com ou sem metaplasia intestinal ou cistite polipoide. Essas lesões devem ser relatadas para que o urologista se correlacione com os achados na cistoscopia. A metaplasia escamosa pode ser do tipo queratinizante ou não queratinizante. No trígono das mulheres, a metaplasia escamosa não queratinizante é considerada uma variação normal da histologia vesical. A metaplasia escamosa não queratinizante geralmente não está associada a fatores irritativos crônicos e risco de neoplasia.
Referência:
Epstein JI, Netto GJ (2014) Differential Diagnoses in Surgical Pathology: Genitourinary System. Lippincoty Williams and Wilkins, Philadelphia.
Autores
Daniel Abensur Athanazio1,2, Luciana Schultz Amorim 3, Isabela Werneck da Cunha 4, Fabio Távora 5,6, Marcela Santos Cavalcanti 7, Stephania Martins Bezerra 8, Emilio Assis 9, Igor Campos da Silva 10, Fernando Korkes 11,12, Roni Fernandes 13, Igor Protzner Morbeck 14, Vinicius Carrera Souza 15, Katia Ramos Moreira Leite 16,17
1 Hospital Universitário Professor Edgard Santos / Universidade Federal da Bahia, Salvador, Brasil
2 IMAGEPAT, Laboratório de Patologia, Salvador, Brasil
3 Instituto de Anatomia Patológica, Americana, Piracicaba & Santa Bárbara d’Oeste, Brasil
4 Departamento de Patologia, Rede D’Or/São Luiz Hospital, São Paulo, Brasil
5 Argos, Laboratório de Patologia, Fortaleza, Brasil
6 Universidade Federal do Ceará, Fortaleza, Brasil
7 Neopath Patologia Diagnóstica, Curitiba – Brasil
8 Departamento de Anatomia Patológica, A.C.Camargo Cancer Center, São Paulo, Brasil
9 CIDAP, Laboratório de Patologia, Juiz de Fora, Brasil
10 Departamento de Patologia, Rede D’Or, Salvador, Brasil
11 Hospital Israelita Albert Einstein, São Paulo, Brasil
12 Faculdade de Medicina do ABC, Santo André, Brasil
13 Rede D’Or/São Luiz Hospital, São Paulo, Brasil
14 Hospital Sírio-Libanês, Brasília, Brasil
15 Oncologia D’Or, Salvador, Bahia, Brasil
16 Laboratório Genoa/LPCM, São Paulo, Brasil
17 Faculdade de Medicina da Universidade de São Paulo, São Paulo, Brasil
